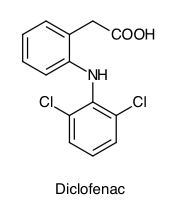
Warum ist Diclofenac schwer wasserlöslich?
Halli Hallo, ich muss anhand der Struktur von Diclofenac feststellen, warum es schwer wasserlöslich ist. Allerdings komme ich nicht auf die Antwort. Kann mir bitte jemand helfen?
3 Antworten

das hängt mit der funktionellen Gruppe -COOH zusammen und mit den bei Chloratomen. Dieses Molekül ist extrem stabil..
LA

Mit zwei aromatischen Sechsringen überwiegen die unpolaren Molekülanteile. Die Amino- und Carboxvlfunktion sind anteilig relativ klein und nicht ionisiert. Die Löslichkeit in Wasser kann deutlich verbessert werden, wenn das Diclofenac entweder in das Natriumsalz oder das Ammoniumsalz überführt wird.

Ja, das wird wohl so der Fall sein. Dann steht einer Carboxylatfunktion unmittelbar das Ammoniumion gegenüber. Das ist dann eine Entsprechung zum Isoelektrischen Punkt von Aminosäuren, die in diesem Zustand die schlechteste Wasserlöslichkeit aufweisen. Gesamtladung gleich Null eben.

Es kommt auf der Verhältnis zwischen polaren Gruppen und dem unpolaren Rest an. Bei OH-Gruppen kann man die Faustregel anwenden, dass eine OH-Gruppe etwa 3 unpolare C-Atome "mitschleppen" kann, ins Wasser, was zu einer Mischbarkeit oder zumindest guten Löslichkeit führt.
Die COOH-Gruppe ist ähnlich polar wie eine OH-Gruppe, der Stickstoff m.W. etwas weniger. Aber insgesamt sind es nur 2 Gruppen auf 13 C-Atome, die reichen nicht.
Müsste nicht im Normalfall ein Zwitterion vorliegen oder verhindert eine intramolekülare H-Brücke?