Lässt sich Stickstoffmonoxid irgendwie zu Stickstoff und Sauerstoff zersetzen?
3 Antworten

NO sollte bei Raumtemperatur spontan in N₂ und O₂ zerfallen, tut das aber bei zivilen Temperaturen ∞ langsam; erst oberhalb von 400 °C beginnt es wirklich, in O₂ und N₂ zu zerfallen. Bei sehr hohen Temperaturen (1600 °C aufwärts, z.B. in Blitzen oder elektrischen Lichtbögen) wird es allerdings stabil und bildet sich in kleinen Mengen aus den Elementen:

(Abbildung aus dem Holleman–Wiberg)
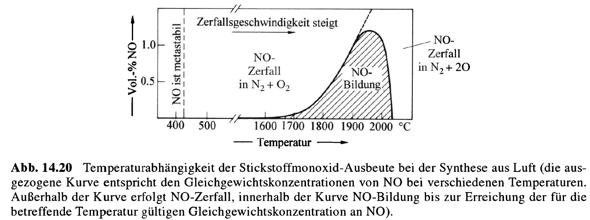

Bei sehr hohen Temperaturen (1600 °C aufwärts, z.B. in Blitzen oder elektrischen Lichtbögen) wird es allerdings stabil
Mich haben die Antworten der anderen schon verwundert, weil ja, wenn es bei sehr hohen Temperaturen instabil wäre, das Birkeland-Eyde-Verfahren gar nicht funktionieren würde. Aber so macht das echt Sinn, danke dir!

Im Prinzip ja, das erfordert aber einen Katalysator und erhöhte Temperaturen. Eine einfache Methode ist meines Wissens bis jetzt nicht bekannt.

Du musst NO nur genug erhitzen oder einen Katalysator zugeben, dann zerfällt es von allein, weil instabil.