Chemie (Reaktion Natriumhydrogencarbonat)?
Wie muss man sich folgendes Gleichgewicht vorstellen:
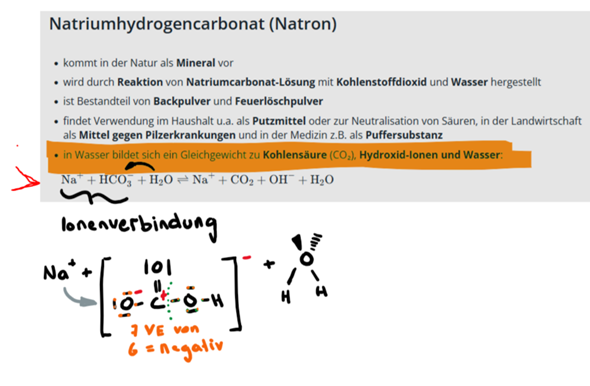
Die Ionenverbindung NaHCO3 zerfällt in Wasser, das ist mir klar. aber wie verhält sich HCO3^- zu H2O? Als Base wäre es ja ein H+-Akzeptor.
Mir erschliesst sich aber nicht, wie man von H2CO3 auf CO^2 + OH^- + H2O kommt.
Oder ist es so, dass sich H2CO3 in H2O und CO2 auftrennt und das OH^- von der Reaktion HCO3^- übrig bleibt? Falls ja, weshalb trennt sich H2CO3 auf?
2 Antworten

Zunächst einmal: Ja, H₂CO₃ ist instabil und steht im Gleichgewicht zu H₂O+CO₂, wobei das Gleichgewict sehr weit auf der Seite des CO₂ steht; pro 1000 C-Atome liegt weniger als eines als H₂CO₃ vor, der Rest als H₂CO₃. Warum das so ist? Zwei OH-Gruppen am selben C-Atom sind fast immer instabil gegen Abspaltung von Wasser und Bildung einer C=O-Doppelbindung.
HCO₃⁻ ist ein Ampholyt. Einerseits ist es eine Base und entreißt einem H₂O das H⁺
HCO₃⁻ + H₂O ⟶ H₂CO₃ + OH⁻ ⟶ CO₂ + H₂O + OH⁻
andererseits kann es aber auch als Säure reagieren und ein H⁺ ans Wasser abgeben
HCO₃⁻ + H₂O ⟶ CO₃²⁻ + H₃O⁺
In der Praxis treten natürlich beide Reaktionen auf, aber die erste läuft etwas leichter ab. Deshalb reagiert eine HCO₃⁻-Lösung ganz leicht alkalisch (etwa pH=8.3). In einer solchen Lösung liegen 98% des Kohlenstoffs als HCO₃⁻ vor und je ungefähr 1% als CO₂ bzw.. CO₃²⁻.

Na + HCO3 + H2O <--> Na + CO2 + OH + H2O
Im Prinzip wird HCO3 zu CO2 und OH
Wenn du auszählst sind auf beiden Seiten 1 H 1 C und 3 O
Mir erschliesst sich aber nicht, wie man von H2CO3 auf CO^2 + OH^- + H2O kommt
Kommt man auch nicht, weil wir hier HCO3 und nicht H2CO3 vorliegend haben