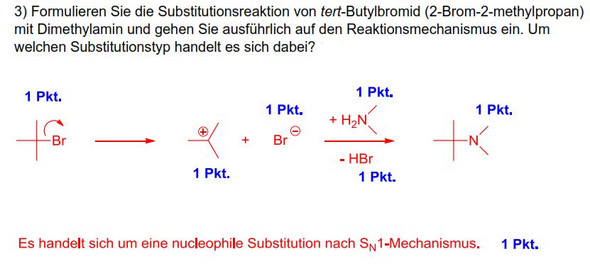
Sollte NH2(CH3)2 in einer Reaktion nicht eher als Radikal reagieren als ein schwaches Nucleophil einer SN1-Reaktion?
Ich verstehe nicht ganz, wieso das Amin plötzlich zwei H-Atome trägt. Stickstoff besitzt 5 Valenzelektronen, durch die Bindung mit einem H-Atom und einer CH3-Gruppe sollte es doch die Edelgaskonfiguration erreicht haben, mit den 10 Elektronen. Müsste dann nicht NH2(CH3)2 ein Radikal sein? Damit wäre es ja keine SN1-Reaktion mehr sondern eher eine radikalische Substitution. Oder hat es irgendwas mit Hyperkonjugation zu tun? Wo liegt mein Denkfehler?