Wieso ist NH4+ eine "nicht-titrierbare" Säure?
Was ist der relevante Unterschied beim Titrieren zwischen dem Ammoniakpuffer (nicht-titrierbar) und dem Phosphatpuffer (titrierbar)?
4 Antworten

Ich muß nochmals eine neue Antwort schreiben, weil man Kommentaren auf alte Antworten keine Bilder hinzufügen kann.
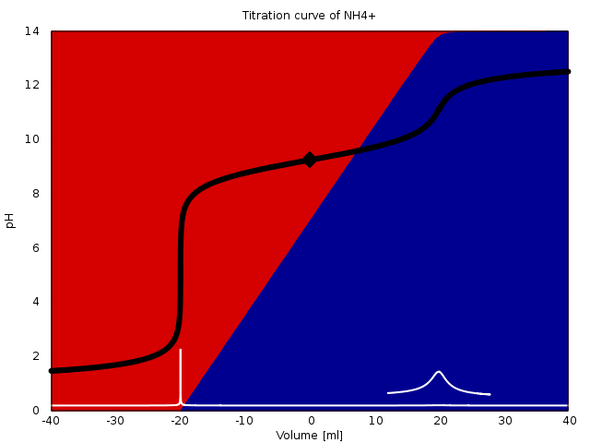
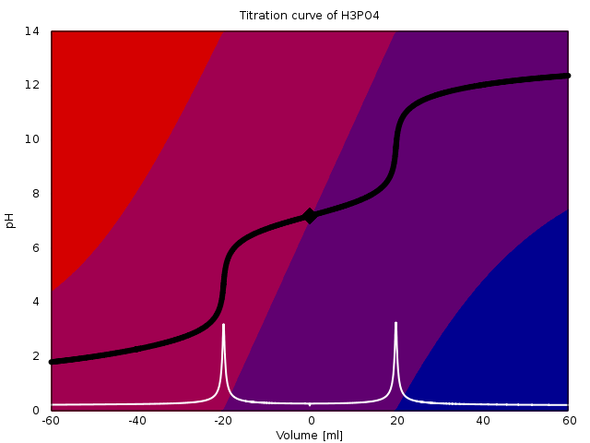
Die zwei Bilder zeigen insgesamt vier Titrationen: Je ein H₂PO₄⁻/HPO₄²⁻-Puffer und ein NH₄⁺/NH₃-Puffer (jede Spezies 0.1 mol/l) werden mit 0.1 mol/l HCl und 0.1 mol/l NaOH titriert. Negative Volumina entsprechen Säureverbrauch, positive Basenverbrauch; der Äquivalenzpunkt liegt bei 20 ml bzw. Vielfachen davon.
Beim Phosphatpuffer sieht man, daß bei Verbrauch ±20 ml ein respektabler pH-Sprung von mehr als zwei Einheiten auftritt. Das ist mit einem gut gewählten Indikator titrierbar, und mit pH-Elektrode auf jeden Fall (die Maxima in der ersten Ableitung sind schön scharf).
Beim Ammoniakpuffer ist das anders. Die Titration mit Säure ist möglich und gibt einen sehr leicht detektierbaren pH-Sprung von knapp 6 Einheiten. Titriert man mit Base, dann sieht man nur einen sehr verwaschenen pH-Sprung um weniger als 2 Einheiten; das zugehörige Maximum in der ersten Ableitung ist erst nach Vergrößerung (um den Faktor 80) sichtbar und ziemlich breit.
Die Titrationen sind jeweils korrekt berechnet, mit allen Gleichgewichten und unter Berücksichtigung der Volumsveränderung durch die Maßlösung. Die Hintergrundfarben geben die Verteilung der beteiligten Spezies an (rot ist H₃PO₄ bzw. NH₃, blau PO₄³⁻ bzw. NH₃, Violettöne sind die Hydrogenphosphate), und das Karo markiert den Anfangspunkt, also die 1:1-Pufferlösung.

Nach längerem Gegrübel verstehe ich, was Deine Frage bedeutet: NH₄⁺ ist eine Säure, aber eine reichlich schwache. Man kann sie in wäßriger Lösung nicht gut titrieren, weil der pH-Sprung am Äquivalenzpunkt nicht hoch genug ist.
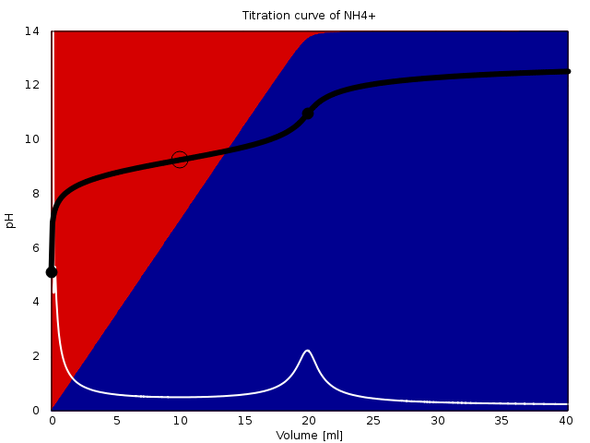
Zum Beweis hänge ich eine solche Titrationskurve an: 20 ml 0.1 mol/l NH₄Cl werden mit 0.1 mol/l NaOH titriert, der Äquivalenzpunkt muß also bei 20 ml Verbrauch liegen.
Am Anfang ist die Lösung leicht sauer, und praktisch aller Stickstoff liegt als NH₄⁺ vor (roter Hintergrund). Im Verlauf der Titration steigt der pH sehr rasch an und es bildet sich immer mehr NH₃ (blauer Hintergrund), und der pH-Anstieg verflacht zunehmend.. Am Äquivalenzpunkt passiert pH-mäßig nicht allzu viel, man beobachtet einen leichten Anstieg, aber es ist eher eine Bodenwelle als ein echter Sprung.
Mit einem Indikator hättest Du keine Chance, den Endpunkt zu finden. Mit einer pH-Elektrode ginge es, aber auch nicht wirklich gut. Man würde dazu das Maximum der ersten Ableitung (eingezeichnet in weiß) heranziehen, aber so richtig superscharf ist das auch nicht.
Wenn man mit 1–5% Genauigkeit zufrieden ist, dann geht es wohl, aber das ist im Vergleich dazu was sonst volumetrisch möglich ist natürlich sehr grob.

Vielleicht stammt die Bezeichnung ja noch aus der Zeit, in der man Indikatoren in Titrationen verwendete. Und da sind Sprunghöhen unter 2 Einheiten nicht zu gebrauchen.
Und denk daran, daß die berechnete pH-Kurve ohne Fehler in der pH-Elektrode, ohne statistisches Rauschen und ohne an der Bürette halbherumhängende Tropfen auskommt. Eine echt gemessene Titrationskurve sieht da wohl noch ein bißchen häßlicher aus.
Eigentlich denkt man bei Volumetrie an 0.1% Genauigkeit und besser. Und davon ist man in diesem Fall wohl ein bis zwei Größenordnungen entfernt.

Wenn Du ein in Wasser gelöstes Ammoniumsalz gegen Natronlauge titrierst entsteht Ammoniak
NH4+ + OH- --> NH3 + H2O
Möglicherweise soll sich die Nichttitrierbarkeit darauf beziehen, daß Ammoniak ein Gas ist, das aus der Lösung entweichen kann. Dadurch würde sich das Verhältnis zwischen NH4+ und NH3 verschieben und Du könntest den Halbäquivalenzpunkt nicht mehr korrekt bestimmen.
Ein starkes Entweichen von Ammoniak wird allerdings nur dann auftreten wenn Du einen sehr konzentrierten Puffer vorliegen hast. Du könntest den Puffer also immer verdünnen, titrieren und dann zurückrechnen.

Wobei ein
Ein starkes Entweichen von Ammoniak
meist an der starken Löslichkeit in Wasser scheitert.
P.S: So ganz habe ich die Frage nicht verstanden, du hast zumindest eine Idee.

Ich glaube, ich konnte das Rätsel lösen: Der pH-Sprung bei einer Titration NH₄⁺ mit NaOH ist einfach zu mager.

Aber im Wikipedia-Artikel gibt es eine Tritrationskurve für Ammoniak

Ja schon, aber für NH₃ (mit HCl), gefragt ist hier aber NH₄⁺ (mit NaOH).
Und die Titrationskurve von NH₄⁺ mit NaOH habe ich an meiner Antwort angeheftet. Wirklich schön sieht sie nicht aus.

Es war aber von einem Ammoniak-Puffer die Rede.
Während du glaubst, es verstanden zu haben, verstehe ich immer noch nur "Bahnhof".
Der Marqius du Mersaque schlägt ein Versöhnungslied vor:
Piep, Piep, Piep, ich titriert' was mir noch blieb.

Wenn Du einen Phosphatpuffer hast (also H₂PO₄⁻ plus HPO₄²⁻), dann kannst Du den sowohl mit NaOH als auch mit HCl titrieren. Damit bestimmst Du jeweils eine Komponente des Puffers, und Du kriegst einen passablen Endpunkt (das sind dieselben zwei, die man auch bei der bekannten Titration von H₃PO₄ so schön sieht).
Einen Ammoniakpuffer kannst Du natürlich mit Säure titrieren (und damit den NH₃-Anteil bestimmen), aber mit Base (um den NH₄⁺-Anteil zu finden) geht das sehr schlecht, aus dem beschriebenen Grund: Am Endpunkt macht der pH einen Hüpfer wie ein lethargischer Elefant auf Valium.

Hm... Wenn ich Deine Antwort richtig verstehe geht es Dir um die Genauigkeit, mit der man den Endpunkte bestimmen kann. Ungenauer Endpunkt heißt dann also "nicht titrierbar".
Das ist ein gutes Argument. Danke für die Erklärung. :o)

Ich vermute, daß es so ist: Man sieht den Endpunkt einfach nicht, oder so gut wie nicht. Man sagt ja z.B. auch, daß die dritte Stufe des Phosphorsäure „nicht titrierbar“ ist, einfach deshalb, weil am Endpunkt kein merklicher pH-Sprung auftritt (allerdings aus etwas anderen Gründen als beim NH₄⁺).

Schwache Säuren wie Ammoniumionen kann man im Prinzip wasserfrei titrieren. Auf die Schnelle habe ich allerdings keine Vorschrift für speziell Ammoniumionen gefunden.
Super Antwort! Damit kann ich leben. Es geht also nicht darum, dass man nicht titrieren KANN, sondern dass das Messverfahren in diesem Fall wegen fehlender Genauigkeit ungeeignet ist.