Wie lauten die Oxidationszahlen für die Verbindung Ag2(S2O3)?
Ich würde sagen Ag2 +I, S2 +II und O3 -II aber ich bin mir nicht sicher, ob es so richtig ist.
Ich bin davon ausgegangen, dass (S2O3)^2- ist, dann sollte Ag2 +I haben. Dann hat Sauerstoff meistens -II. Daher habe ich für S2 +II gerechnet.
Ich bekomme am Ende keine neutrale Verbindung und daher zweifle ich mich an der Richtigkeit meiner Gedanken.
3 Antworten

+1 stimmt für Ag.
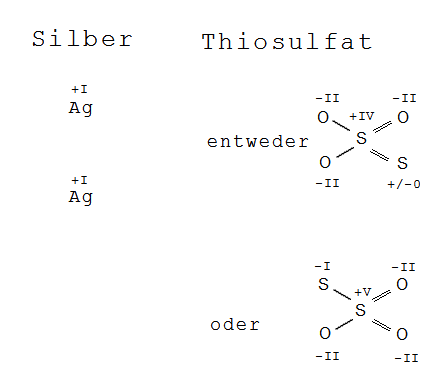
S₂O₃²⁻ ist ein Sonderfall: "Thiosulfat". Die Vorsilbe "Thio-" bedeutet, dass ein Sauerstoffatom durch ein Schwefelatom ersetzt worden ist, in der Regel mit derselben Oxidationszahl wie das ersetzte Sauerstoffatom.
Das Thiosulfat-Ion wird als Beispiel auf https://de.wikipedia.org/wiki/Oxidationszahl erwähnt. Die mittleren Oxidationszahlen der einzelnen Atomsorten berechnen sich aus der Gesamtladung und den üblichen Regeln; hier: 2 * ox_S + 3 * ox_O = -2; ox_O = -2 (wie in Sulfat); also ox_S = +2 (im Muttel).
Schaut man sich die Strukturformel an ( https://de.wikipedia.org/wiki/Thiosulfate ), kann man Näheres sagen:
Nach den üblichen Regeln hat das zentrale Schwefelatom die Oxidationszahl +5, das periphere -1. Aber ich habe auch schon in der Literatur gesehen, dass dem zentralen S-Atom die Oxidationszahl +6 zugewiesen wird (wie im normalen Sulfat) und dem peripheren S-Atom die Oxidationszahl -2 (wie dem Sauerstoff im normalen Sulfat). Begründet wird das mit der gleichen Struktur der beiden Ionen.

Verbindungen habe keine Oxidationszahelen, auch nicht Gruppen von Atomen wie "O3".
Jedes Atom hat seine eigene Oxidationszahl.
S2O3^2- ist nicht, schon gar nicht -2, und Ag2 hat nichts.
Solange du da nicht sauber denkst, wirst du immer Schwierigkeiten haben.
--------------------------------------------------------------
Du hast 2 Ag-Atome, die haben jeweils die OZ +1. In Summe +2.
Du hast 3 O-Atome, die haben jeweils die OZ -2. In Summe -6.
Bleibt also in Summe für die beiden S-Atome +4.
Weil sich ja für die Verbindung in Summe 0 ergeben muss.
Das sagt aber noch nichts über die OZ der beiden S-Atome aus.
Beide könnten jeweils +2 haben, oder eines 0, das andere +4.
In Wirklichkeit (oder gem. PWolff "nach den üblichen Regeln") hat das eine +5, das andere -1.
Das ist eben Schwefel, nicht ohne Grund das Element des Teufels.
Vor allem teuflisch schwierig und vielfältig.

Da findet man in der Literatur und im Netz unterschiedliche angaben. Unterm Strich haben die beiden Schwefelatome aber eine mittlere Oxidationszahl von +II.