Wie lässt sich das erklären?
Ich möchte wussen,warum Cl nur ein Minus hat und unter Cl eine 2 steht,also wie hängt das zsm
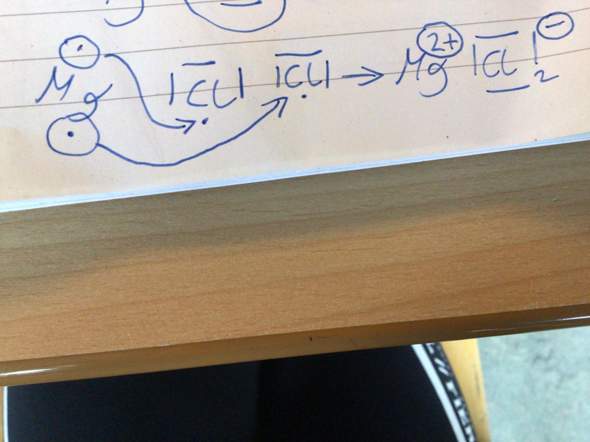
3 Antworten

Moin,
ein Chloratom hat sieben Außenelektronen (Valenzelektronen). Das kannst du daran erkennen, dass Chlor im Periodensystem der Elemente (PSE) in der VII. Hauptgruppe steht. Und die Nummer einer Hauptgruppe verrät dir, wie viele Elektronen in der äußeren Schale eines Atoms sind. Hauptgruppe VII => 7 Außenelektronen.
In der Lewis-Schreibweise stellt man das so dar, dass man um das Elementsymbol von Chlor (Cl = der Atomrumpf) drei Striche (das sind drei freie oder nicht-bindende Elektronenpaare) und einen einzelnen Punkt (das ist ein ungepaartes Elektron) malt. Und genau das siehst du auf deinem geposteten Bild links.
Magnesiumatome haben dagegen zwei Außenelektronen (Magnesium steht in der Hauptgruppe II des PSE, darum haben seine Atome zwei Außenelektronen). Auch das siehst du in deiner Abbildung ganz links.
Wenn nun ein Magnesiumatom auf zwei Chloratome trifft, dann gibt das Magnesiumatom eines seiner beiden Außenelektronen an das eine Chloratom und das andere Außenelektron an das zweite Chloratom ab.
Das passiert, weil das Magnesiumatom gerne eine stabilere Elektronenhülle haben will. Es möchte eine Elektronenhülle wie die von den Atomen des Edelgases Neon haben. Neonatome haben in ihrer Hülle zehn Elektronen insgesamt; davon sind zwei Rumpfelektronen und acht Außenelektronen. Edelgase haben Atome mit besonders stabilen Elektronenhüllen. Deshalb reagieren sie unter normalen Bedingungen praktisch mit keinem anderen Element.
Alle anderen Elemente haben dagegen Atome, deren Elektronenhüllen nicht so perfekt sind, wie die von Edelgasen. Deshalb streben die Atome der anderen Elemente in chemischen Reaktionen danach, eine Edelgaskonfiguration zu erreichen.
Na ja, und wenn ein Magnesiumatom (das zwölf Elektronen insgesamt in seiner Hülle hat, wovon zwei Außenelektronen sind) zwei Elektronen loswerden kann, dann hätte es nur noch zehn Elektronen in seiner Hülle, genau wie ein Atom des Edelgases Neon, verstehst du?
Wenn dagegen ein Chloratom ein einzelnes Elektron von einem Reaktionspartner bekommen kann, dann hätte es 18 Elektronen in seiner Hülle. Und das ist genau die Anzahl an Elektronen, die auch ein Atom des Edelgases Argon besitzt. DAs bedeutet, dass auch ein Chloratom eine Edelgaskonfiguration in seiner Elektronenhülle hinbekommt, wenn es genau ein Elektron aufnimmt.
Unter dem Strich bedeutet das, dass ein Magnesiumatom gerne zwei Elektronen loswerden würde, um eine Edelgaskonfiguration zu erreichen, während ein Chloratom nur ein Elektron aufnehmen will, damit es ebenfalls eine Edelgaskonfiguration erreicht. Damit alle zufrieden sind, brauchst du also ein Magnesiumatom, aber zwei Chloratome, denn dann kann das Magnesiumatom seine beiden Außenelektronen abgeben, während jedes der beiden Chloratome jeweils nur ein Elektron aufnehmen muss. Alle erreichen dabei eine Edelgaskonfiguration und sind zufrieden...
Aber Elektronen sind negativ geladene Atombausteine. Wenn also ein ungeladenes Atom ein Elektron aufnimmt (so, wie es hier das Chloratom macht), dann wird es zu einem einfach negativ geladenen Ion (Chlorid-Anion). Deshalb entsteht ein Cl–-Ion.
Und das Magnesiumatom...? Nun, das Magnesiumatom hat in seinem Kern 12 positiv geladene Protonen und in seiner Hülle 12 negativ geladene Elektronen. Diese Protonen und Elektronen gleichen sich in ihren Ladungen gerade gegenseitig aus, weil von beiden Ladungsträgern gleich viele vorhanden sind (12+ + 12– = 0).
Wenn nun aber ein ungeladenes Magnesiumatom zwei Elektronen abgibt, dann hat es zwar nach wie vor immer noch 12 Protonen (Plusladungen) im Kern, aber nur noch zehn Elektronen (Minusladungen) in der Hüle. Deshalb wird es nach der Abgabe zu einem zweifach positiv geladenen Magnesium-Ion (Mg2+-Ion).
Und so kommt es, dass einerseits Mg2+-Ionen und Cl–-Ionen entstehen, aber andererseits pro Magnesium-Ion ZWEI Chlorid-Ionen gebildet werden.
Deshalb lautet die Verhältnisformel von der Verbindung Magnesiumchlorid MgCl2.
Die tiefgestellte 2 hinter dem Chlorsymbol bezieht sich nämlich nur auf das unmittelbar vor ihr Stehende und das ist das Chlorsymbol. Und genau das willst du ja auch ausdrücken: 1 x Mg und 2 x Cl...
Alles klar?
LG von der Waterkant

Es geht nicht um Zahlen, sondern um die Eigenschaften von Chlor. Das hat 7 Elektronen in der äußersten Schale, was ein unschöner Zustand ist. Daher tun sich 2 Chloratome zusammen und teilen sich ein Elektronenpaar, bilden ein Molekül aus 2 Atomen, Cl₂. Dass dieses geteilte Elektronenpaar ihm nicht allein gehört, kümmert ein Atom nicht, Hauptsache es hat 4 Paare um sich, das berühmte Oktett.
Lieber hat ein Chloratom aber doch 8 Elektronen für sich allein. Daher trennen sich die Chloratome, jedes nimmt ein Elektron auf und du hast 2 negativ geladene Chloridionen Cl⁻.
Du musst die Stoffe verstehen, nicht irgendwelche Rechnungen.

Die 2 auf der Produktseite gehört vor das Cl, nicht darunter. Außerdem arbeitet man nur selten mit atomarem Chlor, wie es auf der linken Seite steht.