Wie können Sie erkennen, welche Elektronen Teil des pi-Systems sind und welche Sie ignorieren können?
2 Antworten

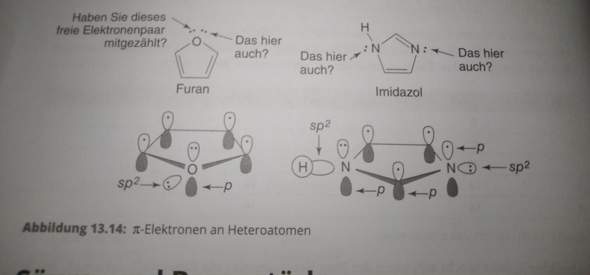
Damit Orbitale bzw. Elektronenpaare am aromatischen System teilhaben können, müssen sie erst mal reinen p-Charakter haben (natürlich senkrecht zum Ring orientiert), dürfen also nicht hybrisiert sein. Es gilt also die Highlander-Regel "es kann nur Einem geben".
Im Furan belegt also ein freies Elektronenpaar das p-Orbital und kann somit am aromatischen System teilhaben, das andere (wie die beiden bindenden) ein sp²-Hybridorbital. Vielleicht mit etwas mehr s-Charakter, weil der Bindungswinkel von 108 ° etwas den p-Charakter der bindenden E.paare fördert, aber das sind Feinheiten.
Im Imidazol sollte das freie E.paar am rechten N-Atom ebenso sp²-Charakter haben. Das p-Orbital wird ja für die π-Bindung bzw. für das aromatische System benötigt. Am linken N-Atom hingegen wird das freie E.paar für den aromatischen Charakter benötigt (Hückel-Regel) und belegt daher ein unhybridisiertes p-Orbital. Das bindende E.Paar zum H ist dafür sp²-hybridisiert. Wiederum vielleicht mit etwas mehr s-Charakter.
Ich hoffe, das "Vorgehen" ist klar geworden.

Die Frage erscheint mir so trivial, dass ich mich kaum traue, darauf zu antworten. Man wird natürlich nicht unterscheiden können, welches der beiden freien Elektronenpaare am Sauerstoffatom des Furans am konjugierten aromatischen π-Elektronensystem beteiligt ist. Nur soviel, es ist eines von beiden. "Haben Sie dieses freie Elektronenpaar mitgezählt?" Wenn ja, dann das nächste natürlich nicht. Wenn nein, dann das andere.
Beim Imidazol zählt nur das freie Elektronenpaar des sekundären Stickstoffs (links) zum π-Elektronensystem des Aromaten. Würde man das freie Elektronenpaar des rechten N einbeziehen, ginge die Konjugation der π-Elektronen verloren und es würde überdies in einer positiven Ladung am N führen. Außerdem hätte man an diesem Stickstoff kumulierte Doppelbindungen, was in einem 5-Ringsystem energetisch kaum machbar ist.

Vielleicht kann man auch damit argumentieren, in dem man auf den größten möglichen Abstand der Elektronenpaare voneinander verweist.
Die Abstände voneinander werden so sein, dass die abstoßenden Effekte im Molekül möglichst gering sein werden und damit die Stabilität maximal. Ein EP wird immer seine PI Elektronen zur Verfügung stellen können.
Denk dran, dass bei Mesomerie die Antwort "irgendwo dazwischen" liegt.

Aber was ich an der Stelle nicht verstehe, ist, dass wenn auch nur ein EP des Sauerstoffs am π-System teilnimmt, dort doch eine Kumulation entsteht...
Die entsteht eben nicht, da zwischen dem O und den benachbarten C eine Einfachbindung vorliegt. Das eine EP ist auf das O begrenzt und wenn man es so sieht, ist es mit den anderen Doppelbindungen in Konjugation und Teil des aromatischen Systems.
,,Man wird natürlich nicht unterscheiden können, welches der beiden freien Elektronenpaare am Sauerstoffatom des Furans am konjugierten aromatischen π-Elektronensystem beteiligt ist."
Aber was ich an der Stelle nicht verstehe, ist, dass wenn auch nur ein EP des Sauerstoffs am π-System teilnimmt, dort doch eine Kumulation entsteht, aber das wollen wir bei einem Aromaten i.d.R. ja nicht, wir wollen, dass es konjugiert ist...
Das mit dem Stickstoff hingegen habe ich zwar verstanden, nur wieder das selbe Problem: Egal wo man das EP vom linken Stickstoff im Aromaten ins π-System einsetzt (egal ob bei Ortho-, Meta- oder Para-Stellung), entsteht wieder an der Stelle eine Kumulation, statt eine Konjugation... Wäre das dann nicht falsch?