Wie entsteht Methyltrichlorsilan?
Hallo auf der Website https://www.lernhelfer.de/schuelerlexikon/chemie-abitur/artikel/herstellung-und-verwendung-von-siliconen
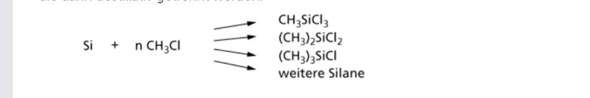
Steht das bei der Herstellung von Silikonen beim ersten Schritt Silizium und 3 Clormethan zu Methyltrichlorsilan reagieren. Wird dann bei der reaktion einfach Chlor frei?
2 Antworten

Nein, das Siliciumatom schiebt sich mittels Katalyse quasi in die C-Cl-Bindungen von 2 Molekülen Chlormethan und es entsteht zunächst Dimethyldichlorsilan. Dieses disproportioniert bei den Reaktionstemperaturen zu Trimethylchlorsilan und Trichlormethylsilan.

Oje! Das ist eine Frage, die ich nicht so genau beantworten kann. Verbindungen (Moleküle) haben nun mal die Eigenschaft miteinander zu reagieren, sofern genügend Energie vorhanden ist, um Bindungen zu spalten, um dann wieder neue Bindungen einzugehen. Ob das dann bei einer Molekülsorte zu einer Disproportionierung führt, also dass aus zwei gleichartigen Molekülen zwei andere entstehen, ist eine Frage der Thermodynamik und des chemischen Gleichgewichts, Es werden die Produkte entstehen, die energieärmer sind.

Und ist die zuvor von mir beschriebene Reaktion dann falsch und wenn ja warum?

Trimethyldichlorsilan existiert nicht. Chlor wird nicht frei, weil die Thermodynamik das nicht hergibt.
Das Si reagiert sowieso im Überschuß Chlormethan, weil das gasförmige Chlormethan auch als Wirbelschichtträger fungiert. Die Katalyse bevorzugt die Bildung von Dichlordimethysilan (je nach Kat und Beimengungen bis zu 90%). D.h. primär bildet sich immer das Dichlordimethysilan und das disproportioniert (relativ langsam) zu den Chlor- & Trichlor- Produkten, am Reaktorausgang (Kondensation) kommt die Disproportionierung komplett zum Stehen.
Welche Reaktion/Reaktionsmechanismus für die geringen Mengen an Disilanen verantwortlich ist weiß ich auch nicht (eventuell Crack- und Umbildungsreaktione)

Trimethyldichlorsilan existiert nicht.
Ja natürlich! Da habe ich mal wieder nicht mit Verstand gelesen.


Der Reaktionsmechanismus a la Müller-Rochow ist nicht wirklich bekannt (zumindest mir, meinen alten Fachbüchern und einer schnellen Google-Recherche 😎), aber egal welche komplexen Zwischenschritte/Übergangsverbindungen stattfinden, das Ergebnis ist eben nahezu komplett Dichlordimethansilan (das dann zu einem geringen Teil disproportioniert). Trichlormethysilan und Cl2 sind einfach keine Option. Wie gesagt, thermodynamisch macht Chlor keinen Sinn und wenn es in geringen Mengen entstehen sollte würde es sofort den Katalysator vergiften.
Das Problem mit dem "was wäre wenn" in der Chemie ist, dass man die schlauesten Vermutungen anstellen kann, aber nur das Experiment zählt und die Ergebnisse überraschen öfters denn nicht...
Ich habe eine Zeitlang mit Trimethysilylcyanid gearbeitet, weil mein Prof vermutete, dass man damit CN-Gruppen übertragen könnte. Super Idee, hat jede Menge Sinn gemacht und nach ca. 300 Ansätzen musste ich berichten, dass es einfach nicht funktioniert 😢

Steht das bei der Herstellung von Silikonen beim ersten Schritt Silizium und 3 Clormethan zu Methyltrichlorsilan reagieren
Das steht nicht auf Deiner Webseite (wäre auch falsch).
Reagieren also 2 Dimethyldichlorsilan Moleküle quasi zu einem Trimethylchlorsilan und Trichlomethylsilan?