Wer kann mir die Funktionsweise eines Puffers erklären?
Hallo,
Ein Puffer verhindert bei Zugabe von Säure oder Base, dass sich der pH Wert zu sehr ändert richtig?
Kann mir jemand die Funktionsweise dahinter erklären? Also wie macht der Puffer das? Vielleicht am Beispiel des Phosphatpuffers?
Vielen Dank! :)
3 Antworten

Moin,
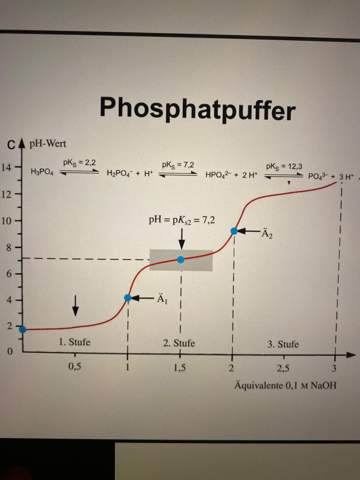
Von einem Puffersystem spricht man, wenn in einer Lösung trotz der Zugabe von Säuren oder Basen der pH-Wert der Lösung weitgehend konstant bleibt.
Puffersysteme erhält man, wenn man gleiche (äquimolare) Mengen einer schwachen Säure (oder Base) mit einer Salzlösung dieser schwachen Säure (oder Base) mischt.
Der Phosphatpuffer besteht zum Beispiel aus Dihydrogenphosphat-Anionen als sehr schwacher Säure (pKs : 7,2) und Hydrogenphosphat-Anionen in gleicher Menge. Obwohl die „Säure” hier sehr schwach ist, ist grundsätzlich eine Protolyse als Gleichgewichtsreaktion in Wasser natürlich möglich:
H2PO4– + H2O ---><--- HPO42– + H3O+
Gemäß dem Prinzip von Le Chatelier (»Prinzip des kleinsten Zwangs«) verschiebt sich das Gleichgewicht in Richtung undissoziierter „Säure” (also nach links), wenn man die Konzentration der Hydrogenphosphat-Anionen (rechts) erhöht. Wenn man also gleiche (äquimolare) Mengen von den (schwach-sauren) Dihydrogenphosphat-Anionen mit Hydrogenphosphat-Anionen mischt:
c(H2PO4–) = c(HPO42– ) oder [H2PO4–] = [HPO42–]
Es gibt außer dem Phosphat-Puffer noch andere Puffersysteme wie den Essigsäure-Acetat-Puffer oder den Ammoniak/Ammoniumchlorid-Puffer (in dem die schwache Base Ammoniak, NH3, mit ihrem Salz Ammoniumchlorid, NH4Cl, äquimolar gemischt vorliegt).
Die Wirkung eines Puffersystems beruht darauf, dass hinzukommende Hydroxidionen (OH– durch die Zugabe einer Base) von der schwachen Säure des Puffers neutralisiert werden, während hinzukommende Protonen (H+ durch die Zugabe einer Säure) von der korrespondierenden Base des Puffersystems (dem Säurerest-Anion) abgefangen werden.
Neutralisation von Hydroxid-Anionen (nach Zugabe einer Lauge):
OH– + H2PO4– ---> H2O + HPO42–
oder das Abfangen von Protonen (nach Zugabe einer Säure):
H3O+ + HPO42– ---> H2O + H2PO4–
Betrachtet man die Titrationskurven von schwachen oder mehrprotonigen Säuren, so kann man feststellen, dass es immer da, wo in der Kurve die Sattelpunkte liegen, es einen Bereich gibt, in dem die Zugabe weiterer Lauge für eine Weile den pH-Wert kaum ändert. Diese Bereiche nennt man Pufferzone. Die Pufferzone liegt demnach um den pKS-Wert der Säure (grob kann man sagen: Pufferzone: pKS ± 1).
Das liegt daran, dass der Sattelpunkt den sogenannten „Halbäquivalentspunkt“ bei der Säure-Base-Titrationskurve darstellt. An diesem Punkt gilt: [HA] = [A–], also dass die Konzentration der undissoziierten Säure (HA) gleich der Konzentration des Säurerestes (A–) ist. Und genau das ist ja auch in extra hergestellten Puffersystemen der Fall...
Ansonsten kann man den konkreten pH-Wert in Puffersystemen mit Hilfe der sogenannten Puffergleichung (Henderson-Hasselbalch-Gleichung) berechnen:
pH = pKs + lg ([A-] / [HA])
Unter der Pufferkapazität versteht man wiederum die Stoffmenge an Säure oder Base, die zum Puffersystem hinzugefügt werden kann, ohne dass sich der pH-Wert nennenswert ändert. Die Pufferkapazität ist abhängig von der Konzentration der Pufferlösung. Auch das ist unmittelbar einsichtig, denn wenn man sehr viel Säure zu einem Puffersystem zugibt, ist irgendwann die Menge an Säurerest-Anionen, die den Protoneneintrag in die Lösung abfangen sollen, verbraucht. Danach führt die weitere Zugabe von Säure wieder zu einem sprunghaften Anstieg der Oxoniumionenkonzentration (so, als hätte es den Puffer nie gegeben). Analoges gilt auch für die Zugabe von Hydroxidionen bei Zugabe einer Base. Und in diesem Zusammenhang dürfte auch unmittelbar verständlich sein, dass es von der Konzentration des Puffers abhängt, wann diese Puffergrenze erreicht wird.
Alles klar?
LG von der Waterkant

Vielen Dank für die Mühe :-) hab’s jetzt viel besser verstanden :)

Kennst du das chemische Gleichgewicht? Das spielt hier die wesentliche Rolle, durch Zugabe verschiebt sich das GG zwar in eine Richtung, allerdings sehr langsam und hält die Reaktionen am laufen.
Ein Puffer hält den pH-Wert einer Lösung konstant, indem er bei Reaktionen freigesetzte Protonen absorbiert bzw. indem er Protonen freisetzt, die dann durch eine Reaktion verbraucht werden. Dem Konzept des Puffers liegt die Tatsache zugrunde, dass teilweise neutralisierte Lösungen aus schwachen Säuren oder Basen ihren pH-Wert auch bei Zugabe geringer Mengen starker Säuren oder Basen beibehalten.

S. auch andere Antworten.
Der Knackpunkt eines Puffers ist: gleiche Mengen einer Säure HA und ihres Anions A-.
Das erreicht man mit schwachen Säuren, die in Wasser praktisch keine Anionen A- bilden und einem ihrer Salze, die in Wasser vollständig A- liefern.
Gibt man nun eine starke Säure z.B. HCl zu, treten die A- des Salzes auf den Plan und fangen nahezu jedes Säureteilchen ab, werden dabei zu HA.
Bei Zugabe einer starken Base z.B. NaOH sind es die HA, die jetzt jede Base abfangen und zu A- werden.
Kurz: im Gegensatz zu starken Säuren und ihren Basen treten die beiden Partner HA und A- erst auf den Plan, wenn sie gebraucht werden, also nicht gegenüber Wasser. Es ist eine Feuerwehr, die erst löscht, wenn es brennt.