Warum kocht Wasser in einem Vakuum?
8 Antworten

Hallo Fragesteller,
wenn Du flüssiges Wasser bei nicht zu hoher Temperatur dem Vakuum aussetzt, wird es zugleich "kochen" und teilweise zu Eis erstarren, weil die Verdampfung dem verbleibenden Wasser Energie entzieht.
In einem Vielteichensystem ist die Temperatur ein Maß für die mittlere Energie der Teilchen. Dabei ist die gesamte thermische Energie freilich nicht gleichmäßig über alle Teilchen verteilt, sondern haben eine Energieverteilung ähnlich der MAXWELL- BOLTZMANN- Verteilung bei Gasen, mit einem dicken "Bauch" bei bestimmten Geschwindigkeiten (und damit Energien) und einer Art "Rattenschwanz", der theoretisch beliebig hoch reicht.
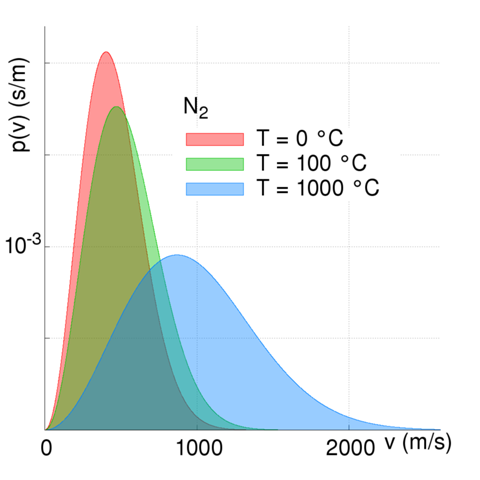
Abb. 1: MAXWELL- BOLTZMANN- Verteilung in Stickstoff für verschiedene Temperaturen.
Eine Flüssigkeit hat auch bei relativ niedriger Temperatur viele Teilchen, deren Energie ausreicht, um die Flüssigkeit zu verlassen. Deren Anteil steigt natürlich mit wachsender Temperatur, und damit steigt auch der Dampfdruck der Flüssigkeit.
Für Festkörper gilt Ähnliches, doch da ist der Dampfdruck generell niedriger.
Wenn der Atmosphärendruck über dem Dampfdruck der Flüssigkeit liegt, der Partialdruck des Dampfes dieser Flüssigkeit aber darunter, verdunstet die Flüssigkeit. Liegt der Dampfdruck über dem Atmosphärendruck, siedet sie. Beides ist ein Übergang vom flüssigen in den gasförmigen Zustand, aber Sieden geht schneller.
Ein Reinstoff hat mindestens einen Tripelpunkt, einen Punkt in einem Druck- Temperatur- Diagramm, an dem er in allen drei Phasen (fest, flüssig und gasförmig) vorkommen kann. Bei Atmosphärendrücken unterhalb des Tripeldrucks kommt der Stoff nur in fester und gasförmiger Form vor; der Feststoff sublimiert bzw. der Dampf resublimiert.
Bei Wasser liegt er bei rund 6 HPa (bzw. mbar) und der Temperatur von 273,16 K (0,01°C).
Dass Eismonde etc. nicht komplett wegsublimieren, dürfte daran liegen, dass sie den Wasserdampf durch ihre Gravitation festhalten können und der genügend Druck entwickelt, um weiteres Sublimieren zu verhindern. Außerdem enthalten sie viele Mineralien, die Wassermoleküle an sich binden und die Sublimationstemperatur erniedrigen.




Flüssigkeiten verdunsten bzw. verdampfen, denn die Teilchen der Flüssigkeit besitzen eine hohe Eigenbewegung und können leichter lösen und entweichen, als z.B. aus einem Feststoff. Der Gegendruck der Erdatmosphäre hemmt die Teilchen aber zu entweichen. Im Vakuum gibt es keinen bzw. keinen nennenswerten Gegendruck und Wasser kocht und verdampft daher.

Im flüssigen Wasser werden die Moleküle einerseits durch zwischenmolekulare Kräfte und andererseits durch die Oberflächenspannung zusammengehalten. Dennoch besitzen nicht alle Moleküle die gleiche Geschwindigkeit. Manche sind langsamer als die Mehrheit und manche sind schneller als die Mehrheit. Steht Wasser in Kontakt mit Luft, dann können einzelne Moleküle die flüssige Phase verlassen und in die Gasphase übergehen. Umgekehrt können Wassermoleküle aus der Gasphase wieder in die flüssige Phase eintreten. Im thermodynamischen Gleichgewicht verdunsten dann genauso viele Teilchen, wie Teilchen kondensieren., d.h. es kann kein weiteres Wasser verdunsten. Die Luft ist gesättigt und man bezeichnet den Partialdruck des Wassers in der Luft dann als Sättigungsdampfdruck. Übersteigt der Sättigungsdampfdruck den Umgebungsdruck fängt die Flüssigkeit an zu sieden.
Bildlich gesprochen: Der Umgebungsdruck hält die Teilchen quasi in der Flüssigkeit gefangen. Wenn sie jedoch diesen Druck überwinden, können sie ausbrechen.
Der Sättigungsdampfdruck ist von der Temperatur abhängig. Für Wasser beträgt er bei 25°C 3.17 kPa (zum Vergleich: der Umgebungsdruck beträgt ca. 100 kPa). Wenn nun der Umgebungsdruck abfällt, kann es ebenso dazu kommen, dass der Sättigungsdampfdruck den Umgebungsdruck überschreitet und das Wasser siedet. Im Vakuum passiert genau das. Ein ideales Vakuum beinhaltet gar keine Teilchen und bietet somit auch keinen Umgebungsdruck. In der Realität weist ein Vakuum jedoch immer einen Druck auf, deswegen kann man ein Vakuum thermodynamisch einfach wie eine Gasphase mit stark vermindertem Druck behandeln. Der Sättigungsdampfdruck von Wasser wird dann aber praktisch immer unterschritten.

Wasser kocht, wenn sein Dampfdruck den Außendruck übersteigt. (Das ist bei jeder Flüssigkeit so.)
Auf Meeresspiegelhöhe ("Normaldruck") liegt der Siedepunkt des Wassers bei ziemlich genau 100 °C. Auf einem Berg (niedrigerer Luftdruck) siedet Wasser schon bei niedrigeren Temperaturen. (Bei welcher Temperatur, kann man der Dampfdruckkurve entnehmen.)
Welchen Außendruck hat man im Vakuum? (Um genau zu sein, ist der Druck eines "technischen Vakuums" immer noch größer als 0.)
Wenn die Temperatur unter dem Gefrierpunkt (beim entsprechenden Druck) liegt, siedet das Wasser nicht, es "sublimert" nur an der Oberfläche.


Weil der Siedepunkt eben von verschiedenen Faktoren abhängig ist.

Jetzt schreibe ich wohl eine Eins in Physik! Dankeschön🙏