Warum diese Oxidationszahlen?
Hallo zusammen,
kann mir jemand erklären, wie man auf die gelb hinterlegten Oxidationszahlen kommt? Mir ist absolut nicht klar, wie man darauf kommt, dass Kupfer = +2 und NO3 = -1 als Oxidationszahlen hat. Kann mir da jemand auf die Sprünge helfen?
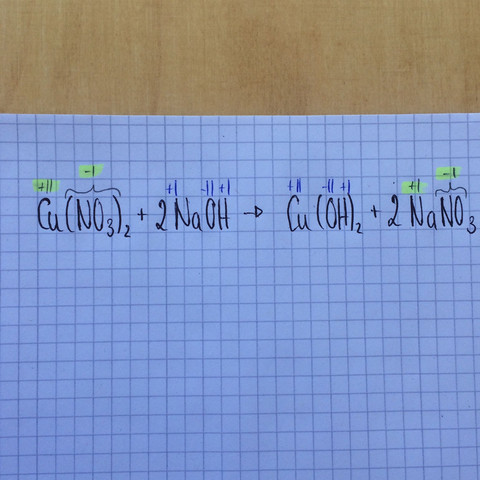
3 Antworten

Sauerstoff ist in nahezu jeder chemischen Verbindung 2fach negativ. kann man der Position im PSE ablesen.
3*-II =-VI, Sauerstoff ist der elektronegativere Part, heißt er gibt die Elektronen und reduziert.
Der Stickstoff hat die Oxidationzahlen von -III, +II, +III, +IV oder+ V. Um eine Verbindung mit 3 Sauerstoffatomen einzugehen, muss der Stickstoff also die höchte Oxidationszahl aufbringen (+V), da nur der ein derartigen Elektronenmangel hat um derart viel aufzunehmen.
-VI(Sauerstoff)+V(Stickstoff)=-I, -I ist auch die Gesamtoxidationszahl von NO3. An der untergestellten Oxidationszahl ist es ersichtlich das Molekül Cu(NO3)2 ,2 davon besitzt. 2*-I=-II
Cu kommt als Metall nahe zu immer in positiven Oxidationszahlen vor, also +I oder +II als Ion
Cu(NO3)2 ist nach außenhin neutral geladen (kein Verweis rechts ober einer Ionenladung)
Bedeutet das Kupfer muss eine Oxidationszahl von +2 besitzten um die Ladung der beiden einfach negativen Nitrat-Moleküle auszugleichen um nach außenhin neutral zu sein.
So würde ich alles einzeln aufgedröselt behandeln um auf die Oxidationszahlen zu kommen.

DANKE!
Dass Stickstoff maximal +V haben kann, war mir gar nicht klar, dann wäre ich wahrscheinlich von selbst drauf gekommen. Super. :)

Hallo LinaRaw
die Oxidationszahlen (OZ) werden nach bestimmten Regeln festgelegt.
Elemente, auch die 2-atomigen haben die OZ 0.
Bei 1-atomigen Ionen ist die OZ gleich der Ladung, Cl^- hat die OZ -1
Bei neutralen Molekülen ist die Summe der OZ gleich 0, bei mehratomigen Ionen ist die Summe der OZ gleich der Ladung.
Jetzt zu der Reihenfolge, die durch die Elektronegativität bestimmt ist:
Fluor hat in Verbindungen immer die OZ -1
Sauerstoff hat in Verbindungen die OZ -2 (hier gibt es Ausnahmen)
Wasserstoff hat in Verbindungen die OZ +1 (auch hier gibt es Ausnahmen)
Metalle haben in Verbindungen positive OZ (Ausnahmen sehr selten)
Wenn zwei Nichtmetalle miteinander verbunden sind, hat der elektronegativere Partner die negative OZ.
Um nun die OZ zu bestimmen, muss man diese Liste 'abarbeiten'.
Beispiel:
Cu(NO3)2 lässt sich aufspalten in Cu^2+ und 2 NO3^-, wobei NO3^- das Säurerestion der Salpetersäure ist - dies muss man wissen !
Fluor ist nicht enthalten, als nächstes Sauerstoff hat die OZ -2. Damit nun das NO3 einfach negativ wird, muss die OZ des Stickstoffs + 5 betragen.
3 x (-2) vom Sauerstoff + 1 x (+5) vom Stickstoff = -1
Da zwei Ionen NO3^- vorhanden sind, muss zum Ausgleich der OZ das Cu die OZ +2 haben, was sich auch mit der Ladung deckt.
Analog verhält es sich mit dem NaNO3, nur das hier ein Nitration vorhanden ist, und somit zum Ausgleich der OZ das Natrium die OZ +1 erhalten muss.
Anmerkung:
Für die Reaktion, die du angegeben hast ist eine Betrachtung der OZ nicht nötig, da es sich um eine Säure-Base-Reaktion handelt und nicht um eine Redox-Reaktion, bei der sich die OZ ändern.
LG


Zunächst mal für NO3. Sauerstoff hat ja bekanntlich immer die Oxidationszahl -II (mit ein paar Ausnahmen, die hier allerdings nicht auftreten). Davon gibts drei Stück. Also haben wir schon mal -VI. Der Stickstoff in der Verbindung verliert dann logischerweise seine Elektronen. Bis zur Edelgaskonfiguration von He kann er fünf Stück abgeben. Das muss er auch, weil die an ihn gebundenen Sauerstoffatome ja sechs haben wollen. N hat also die Oxidationsstufe +V. +V und -VI ergibt dann -I für NO3.
Das Kupfer kann im Normalfall zwei Elektronen abgeben. (Für Übergangsmetalle ist das mit den Oxidationszahlen immer so ne Sache.) Da NO3 aber nur noch eines braucht (für die O's, die ja nur 5 von 6 vom N bekommen haben), gibt das Kupfer je ein Elektron an zwei NO3 Moleküle.
Wenn noch was unklar ist, bitte fragen.

Danke. Hast mir sehr geholfen.
Ja, darum ging es bei der Aufgabe, also herauszufinden ob es eine Redox-Gleichung ist oder nicht.