Chemie: Redoxreaktion und Oxidationszahlen?
Es handelt sich hier um eine Redoxreaktion. Dabei müssen wir Oxidationszahlen verstehen.
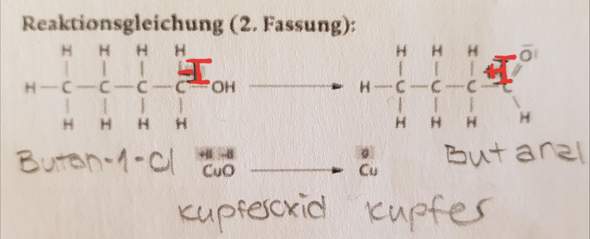
Butan-1-ol: Warum hat das C dort die Oxidationszahl -I (rot markiert) ? Wie kommt man auf -I ?
Butanal: Gleiche Frage. Warum ist die Oxidationszahl bei dem C +I ? (auch rot markiert)
Könnt ihr mir erklären wie man darauf kommt? Ist die Oxidationszahl von der Anzahl der C-Atome abhängig?
Hat zum Beispiel das C bei Ethanol die selbe Oxidationszahl wie auch bei Butan-1-ol ?
Danke für Hilfe 😊🥺
2 Antworten

Moin,
darauf kommt man wie folgt:
Zunächst musst du bei der Ermittlung der Oxidationszahlen in Molekülen mit Atombindungen stets die Elektronegativitäten der Bindungspartner kennen, um sie vergleichen zu können.
Dann musst du wissen, dass bindende Elektronenpaare immer dem elektronegativeren Bindungspartner vollständig zugesprochen werden (auch wenn die Differenz in der Elektronegativität nur minimal ist).
Haben aber zwei Bindungspartner exakt dieselbe Elektronegativität (EN), dann wird das bindende Elektronenpaar geteilt, das heißt, jeder Bindungspartner erhält ein Elektron zugesprochen.
Zum Schluss vergleichst du, wie viele Elektronen ein Bindungspartner NACH DER ZUTEILUNG hat und vergleichst das mit der Valenzelektronenmenge, die das betreffende Atom im ungebundenen Zustand hat.
Machen wir das für die von dir angesprochenen C-Atome:
Im Butan-1-ol ist das erste C-Atom einmal mit einem weiteren C-Atom, dann noch mit einem O-Atom sowie mit zwei H-Atomen verbunden.
C hat eine EN von 2,5
H hat eine EN von 2,2
O hat eine EN von 3,5
Die beiden Bindungen zu den H-Atomen werden vollkommen dem C-Atom zugesprochen, weil es im Vergleich mit den H-Atomen die größere EN hat. Die Bindung zu dem O-Atom wird dem O-Atom zugesprochen, weil es eine höhere EN hat. Die Bindung zu dem anderen C-Atom wird gerecht aufgeteilt, weil die EN von C und C natürlich exakt gleich groß ist.
Das macht zusammen (1 + 2 + 2 + 0 =) 5 Elektronen (nach der Zuteilung). Ein ungebundenes C-Atom hat dagegen 4 Elektronen. Das bedeutet, dass das C-Atom nach der Zuteilung der Bindungselektronen nun ein Elektron mehr hat. Da ein Elektron aber ein einfach negativer Ladungsträger ist, hat dieses C-Atom nun formal eine Minusladung mehr. Darum hat es die Oxidationszahl –I.
Nun machen wir das gleiche beim entsprechenden C-Atom im Butanal. Hier ist dieses C-Atom immer noch mit einem anderen C-Atom verbunden. Außerdem mit einem H-Atom und schließlich hat es eine Doppelbindung zu einem O-Atom. An den EN-Werten hat sich ja nichts geändert, so dass das Elektronenpaar zwischen den C-Atomen aufgeteilt wird, das Elektronenpaar zum H-Atom wird dem C-Atom zugesprochen, während beide Elektronenpaare der Doppelbindung vollständig dem O-Atom zugeteilt werden.
Das macht (1 + 2 + 0 + 0 =) 3 Elektronen nach der Zuteilung. Und das bedeutet, dass dieses C-Atom nun im Vergleich mit einem ungebundenen C-Atom ein Elektron weniger hat. Ein Elektron weniger ist aber so, als hätte dieses C-Atom ein Elektron abgegeben. Darum hat es nun die Oxidationszahl +I.
Und wenn du dann noch die beiden C-Atome im Zusammenhang miteinander vergleichst, ist es formal so, als hätte das C-Atom im Butanol (OZ: –I) nun im Butanal (OZ: +) zwei Elektronen abgegeben...
Alles klar?
LG von der Waterkant


Einen primären Alkohol kann man allgemein wie folgt schreiben:
R – CH2OH
Die Oxidationszahlen von H und O sind Dir ja bekannt.
Der R-Rest hat immer die OZ = 0
Durch Berechnung kommst Du dann für den C (s. oben) auf OZ(C) = -I
Bei Alkanalen kann man die Schreibweise ebenfalls abkürzen in R – COH (die Aldehydgruppe kann man bei gfn nicht in Strukturschreibweise darstellen). Du kommst hier auf OZ(C) = +I