Schwefeldioxid Lewis Schreibweise Erklärung?
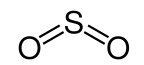
Warum ist bei Schwefeldioxid (SO2) die Lewis Schreibweise folgendermaßen, wenn Schwefel doch mit o2 2x Doppelbindungen eingeht hatte es doch 10 Valenzelektronen, oder ?
Bitte deckt meinen Denkfehler auf, LG
2 Antworten

Schwefel hat auch im SO2 nur 8 Elektronen. Allerdings sieht man das in der Lewis Schreibweise nicht, weil es sich bei der pi-Bindung um eine Mehrzentren Bindung handelt.
Im MO-Schema sieht man das allerdings:
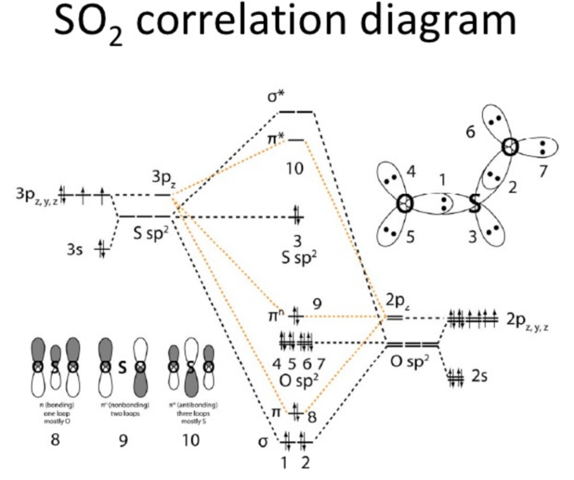
Vom Schwefel und von den Sauerstoffatomen kommen je 6 Elektronen. Es gibt zwei sigma Bindungen mit je zwei Elektronen (Orbitale 1 und 2 im Bild), dann eine pi-Bindung (Orb. 8). Außerdem einige nichtbindende Orbitale. Dazu gehören die freien Elektronenpaar an den Sauerstoffatomen (Orb. 4, 5, 6, 7), das am Schwefel (Orb. 3) und das pi-Orbital Nr. 9. Auf das kommts hier an. Das ist nämlich nicht-bindend und wie man unten links sieht nur an den Sauerstoffatomen lokalisiert.
Zählt man also die Elektronen: Sauerstoff 1 kriegt je 2 Elektronen von den Orbitalen 1, 4, und 5 und je eines aus 8 und 9 (weil die delokalisiert sind), macht 8. Für Sauerstoff 2 genauso. 2 Elektronen aus 2, 6 und 7 und 1 aus 8 und 9.
Beim Schwefel sind es je 2 aus 1 und 2 (die sigma Bindungen), 2 aus der 3 (das freie Elektronenpaar) und nochmal 2 aus 8 (die pi-Bindung). Von der 9 kriegt es allerdings nichts.
Vereinfacht gesprochen, ist die Zählung von 8 deswegen so komisch, weil die Elektronen eben delokalisiert sind. Es befindet sich durchschnittlich je eins in den beiden S-O Bindungen, daher zählt es für S als zwei für die beiden O aber nur als eins. Das 9er Orbital dagegen "schwingt" quasi zwischen den beiden O hin und her und lässt den Schwefel außen vor. Daher kommen auch die mesomeren Grenzformeln: O=S-O und O-S=O, was die Bindung etwas anschaulicher darstellt, vor allem was das Oktett am Schwefel angeht.
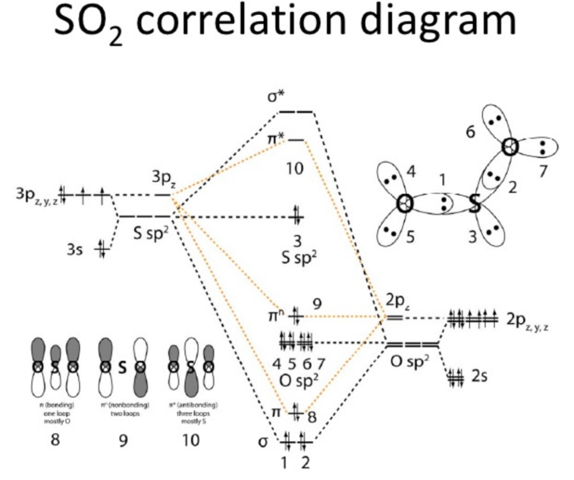

Macht schon Sinn, wenn man Mechanismen etc formulieren möchte. Da kann man aber auch eine der Grenzformeln nehmen. Das kommt übrigens öfter mal vor, dass die Lewis-Schreibweise nicht so ganz die realen Bindungsverhältnisse wiedergibt.
KCl kannst du höchstens als Lewis schreiben, wenn du dem K keine Elektronenpaare gibst und um das Cl 4 Stück machst plus die Ladungen bei beiden. Aber eine gerichtete Bindung gibts da nicht.

Hm S und O haben jeweils 6e als Valenzelektronen. Insgesamt gibt es 18 e oder 9 e Paare die zu verteilen sind. 4 Paare bilden die Doppelbindunden. 4 freie e Paare am Sauerstoff und 1 freies Paar am Schwefel.

Danke für die Antwort. Trotzdem verstehe ich nicht warum man hier dann nicht nach dem Valenzzustand geht sondern nach den Unterschalen. Ich zähle nur 16e , im Schwefel 2 einzelne im 3p, 10e in 3d und bei den beiden Sauerstoffatomen jeweils 2 einzelne 2s Elektronen!

die Elektronen in den d Orbtalen tragen nicht zur Bindung bei.
Vielen Dank für die Mühe, macht es dann überhaupt Sinn das in Lewis Schreibweise du Formulieren? Und ganz kurz KCl kann man nicht als Lewis formulieren weil das Kalium ein Elektron abgibt oder?