Schwefel Elektronenbindung?
Schwefel ist in der 6.Hauptgruppe und besitzt dementsprechend 6 Valenzelektronen. Zudem befindet es sich in der 3 Periode und hat 18 Schalen.
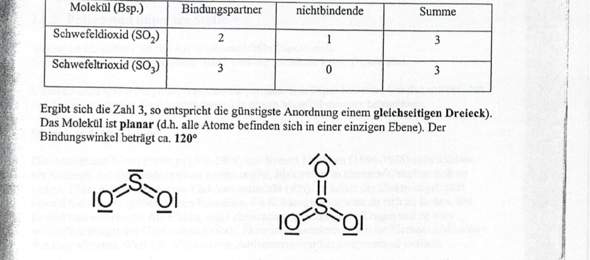
Ich verstehe jedoch nicht wieso Schwefeldioxid 10 Elektronen und in Schwefeltrioxid 12 Elektronen in der Bindung hat. Damit es jedoch die Oktettregel erfüllen kann, braucht doch Schwefel 18 Valenzelektronen.
2 Antworten

Für die Oktettregel braucht Schwefel 8 Elektronen, z.B. in H₂S oder SCl₂ oder S₂Cl₂ oder organischen Mercaptanen. Weil octo soviel heißt wie „acht“.
Aber wie alle Elemente nach der ersten Achterperiode ist Schwefel nicht an die Oktettregel gebunden, sondern kann auch 10 oder 12 Elektronen vertragen. Für SO₂ und SO₃ kannst Du auch Formeln schreiben, die die Oktettregel erfüllen, um den Preis von Formalladungen und mehreren mesomeren Grenzstrukturen. Aber diese Strukturen wirken doch recht gekünstelt, und bei Vögeln wie SF₆ kommst Du um die erweiterte Oktettregel ohnehin nicht herum.
Deshalb sagst Du am besten: Bei SO₂ (oder auch SOCl₂ oder SF₄) hat der Schwefel kein Oktett sondern ein Dezett, und bei SO₃ (oder SF₆ oder H₂SO₄) hat der Schwefel sogar ein Dodezett.
(Es gibt sogar Verbindungen mit einem Tetradezett, z.B. IF₇ und mit einem Hexadezett, z.B. XeO₄. Aber solche Fälle sind selten; häufig als „erweiterte Oktette“ sind nur die Dezette und Dodezette).

Frohe Ostern!
Zur sog. Oktettaufweitung, bei der ich das "sog." auch erst lernen musste, schick' ich dir über die Feiertage ein paar Links, oder lass es wahrscheinlicher bleiben.
Ist Physikalische Chemie über meinem Niveau, kann ich auch nur hinnehmen, auch wenn es heftig in mir rumort.
Beim Schwefelhexafluorid bindet jedenfalls jedes p-Orbital mit jeder Keule ein F-Atom. Macht 6 halbe Bindungen, also 3 Bindungen. Dazu kommt eine Siebenzentren-Zweielektronische-S-Sigmabindung, macht zusammen 4 Bindungen, ohne das Oktett zu überschreiten.
Bei Sulfaten und Konsorten wird das Ganze auch noch hybridisiert, was die Sache nicht wirklich einfacher macht.
Ich wehre mich auch etwas dagegen, dass 3d-Orbitale, die beim Sc völlig lässig daherkommen, beim S oder Cl, so knapp ein halbes Dutzend Ordnungzahlen vorher, "energetisch völlig unmöglich" sind. Aber ich bin eben nur Nebenfachchemiker.

Du darfst auch nicht davon ausgehen, dass ein Bindungspartner alle Elektronen zu sich zieht. Schwefel und Sauerstoff teilen sich hier die Elektronen.

Übrigens sind die 18 Elektronen auch nicht alle in den Bindungen und freien Elektronenpaaren zu sehen. Das sind nur die Valenzelektronen.

SO3 hat selber 6 VE und teilt sich dann in der Verbindung mit Sauerstoff 12 Elektronen. Aber dann erfüllt es doch nicht die oktettregel ?

Man kann Verbindungen wie SO3 oder SO4 auch nur begrenzt mit der Schulchemie erklären. der punkt ist, dass die atome nach voll besetzten Orbitalen streben. Das geht dann aber schon in die komplizierte MO Theorie.