Redoxreaktion ausgleichen ionenladung?
Ich lerne gerade für meine Chemie Klausur und habe noch ein paar Probleme. Ich soll die Redoxreaktion zu Chromat und Chlorid reagieren zu Chrom3Ionen und Chloriger Säure aufstellen. Jetzt komme ich beim ausgleichen der Ionenladung nicht weiter.
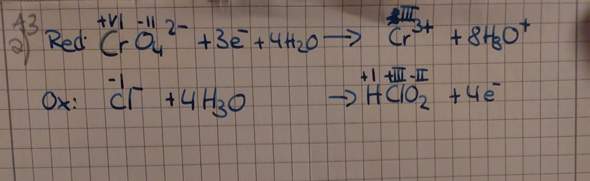
Das habe ich bisher

Schon mal versucht, das H3O+ auf die andere Seite zu schreiben?

Auch dann komm ich nicht weiter, da ich nach meinen Berechnungen eine ungerade Anzahl an H aber gerade Anzahl an O brauche
3 Antworten

Es gibt da zwei Methoden, die natürlich letztlich auf's selbe rauskommen.
Bei der VORLÄUFIGEN Gleichung CrO₄²⁻ + 3 e⁻ -> Cr³⁺ hast du links die Ladung -5, rechts +3. Die Ladung erhöht sich um 8. Du fügst also links 8 Oxonium zu, und rechts Wasser, wie sich ergibt. CrO₄²⁻ + 3 e⁻ + 8 H₃O⁺ -> Cr³⁺ + 12 H₂O.
Chrom links wie rechts 1 ✅
Sauerstoff links wie rechts 12 ✅
Wasserstoff links wie rechts 24 ✅
Ladung links wie rechts +3 ✅
Bei der VORLÄUFIGEN Gleichung CrO₄²⁻ + 3 e⁻ -> Cr³⁺ hast du vier formale Oxidionen, die du "loswerden" musst, also zu Wasser protonieren. Dazu brauchst du 8 Oxoniumionen. Es entstehen 4 H₂O aus den ehemaligen "Oxidionen" und 8 bleiben vom Oxonium übrig, ergibt 12.
Die Gleichung und die Probe entspricht Methode 1.

Das wär ja jetzt die Gelegenheit, es mal selbst zu probieren, nach Methode 1 und 2. Noch bin ich wach, für den ✅.


Du mußt nur ausgleichen. Wir beginnen mit einer rohen Form der beiden Teilgleichungen, und gleichen dann aus:
Cr⁺ⱽᴵO₄²¯ + 3 e¯ ⟶ Cr³⁺
Cl¯ ⟶ Cl⁺ᴵᴵᴵO₂¯ + 4 e¯
Da die Reaktion vermutlich im Alkalischen abläuft, gleichen wir mit OH¯ und H₂O aus. Die obere Gleichung will 4 O-Atome auf der Eduktseite loswerden, da schreiben wir vier H₂O hin und rechts 8 OH¯. Bei der unteren machen wir dasselbe, nur in die andere Richtung und für nur zwei O-Atome:
CrO₄²¯ + 4 H₂O + 3 e¯ ⟶ Cr³⁺ + 8 OH¯
Cl¯ + 4 OH¯ ⟶ ClO₂¯ + 2 H₂O + 4 e¯
Ein Ausgleich mit H₃O⁺/H₂O wäre am Papier auch möglich, aber er kommt mir chemisch unplausibler vor. Statt H₂O käme dann H₃O⁺ und statt OH¯ käme H₂O:
CrO₄²¯ + 8 H₃O⁺ + 3 e¯ ⟶ Cr³⁺ + 12 H₂O
Cl¯ + 6 H₂O ⟶ ClO₂¯ + 4 H₃O⁺ + 4 e¯
Wie auch immer Du es machen willst, im letzten Schritt werden die beiden dann geeignet multipliziert (Reduktion mit 4, Oxidation mit 3) und zusammenaddiert:
4 CrO₄²¯ + 3 Cl¯ + 10 H₂O ⟶ 4 Cr³⁺ + 3 ClO₂¯ + 20 OH¯
4 CrO₄²¯ + 3 Cl¯ + 20 H₃O⁺ ⟶ 4 Cr³⁺ + 3 ClO₂¯ + 30 H₂O
Allerdings haben beide Gleichungen noch ihre Schwächen. Im Alkalischen würde Cr³⁺ in Abwesenheit von irgendwelchen Komplexbildnern als Cr(OH)₃ ausfallen, und im Sauren liegt kein Chromat, sondern Dichromat vor, und im stark Sauren würde Chlorit als chlorige Säure vorliegen. Das können wir bei Lust auch noch berücksichtigen:
4 CrO₄²¯ + 3 Cl¯ + 10 H₂O ⟶ 4 Cr(OH)₃ + 3 ClO₂¯ + 8 OH¯
2 Cr₂O₇²¯ + 3 Cl¯ + 19 H₃O⁺ ⟶ 4 Cr³⁺ + 3 HClO₂ + 27 H₂O

Doch das geht schon auf:
CrO4^2- + 3 e^- + 8 H3O^+ -> Cr^3+ + 12 H2O
Cl^- + 5 H2O -> HClO2 + 4 e^- + 3 H3O^+

Uns wurde gesagt, dass man sich die Ionenladungen angucken muss. Sie ändert sich ja bei der Oxidation von minus 1 auf plus 3, also ein Unterschied von 4. Uns wurde es so beigebracht, dass man dann 4H30+ ergänzen muss. Daher verstehe ich es nicht so ganz. Bei der Reduktion habe ich keine Probleme. Hatte es nur oben zuerst vertauscht

Du musst dir die Gesamtladung anschauen, nicht nur die vom Chrom. Die Elektronen haben auch eine.
Letztendlich muss auf beiden Seiten der Gleichung dieselbe Ladung stehen.
Danke das ist sehr verständlich, wie wäre es bei der Oxidation?