Polare oder unpolare Atombindung bei Ammoniak?
Haben Ammoniak, das Cyanid Molekül und das Sauerstoff Molekül eine polare oder unpolare Atombindung und sind sie dipolar oder nicht?
2 Antworten

Ich bin mir nicht mehr ganz sicher, wie das mit Dipolen war ist schon eine ganze Weile her, dass ich mich das letzte mal damit auseinandergesetzt habe, aber zu polar und unpolar kann ich denke ich etwas sagen. Für die Polarität sind sowohl die Elektronegativitäten als auch der räumliche Aufbau des Moleküls von Bedeutung. CO2 etwa hat zwei O-Moleküle, die deutlich elektronegativer sind, als das an sie gebundene Kohlenstoffatom. Somit sind die O-Moleküle partiell negativ und das C Molekül partiell positiv geladen. Die erste Vorraussetzung für einen polaren Stoff, nämlich eine Ladungsdifferenz zwischen einzelnen Atomen einer Verbindung ist somit gegeben. Dadurch ergibt sich meine ich jetzt der Dipol also ein elektrisches Feld zwischen der positiven und der negativen Ladung (da bin ich mir aber nicht mehr ganz sicher).
Nun zu der räumlichen Struktur. CO2 ist ein lineares Molekül. Der Bindungswinkel zwischen dem C-Atom und den O-Atomen beträgt somit 0° bzw 180° je nachdem wie man schaut. Dadurch gibt keine Stelle innerhalb des Moleküls, die nach außen ragt und eine andere Ladung hat als der Rest des Moleküls. Außerdem sind die beiden Enden des Moleküls gleich stark geladen und deren Wirkung hebt sich dadurch auf. Deshalb ist es unpolar.Wasser hingegen hat einen von 0° bzw 180° verschiedenen Bindungswinkel aufgrund der freien Elektronenpaare des Sauerstoffes. Dadurch ragt der partiell negativ geladene Sauerstoff heraus, während sich die positiven Wasserstoffe auf der gegenüberliegenden Seite befinden. So bilden sie zwei Pole -> polar.
Eine andere Betrachtungsweise wäre sich die Symmetrien durch den Molekülmittelpunkt anzuschauen (Bild für bessere Erklärung). Bei CO2 liegt immer eine Achsen- oder Punksymmetrie vor, wenn das elektrische Feld betrachtet wird. Bei H2O hingegen gibt es mehrere Achsen in denen keine Symmetrie vorliegt, weshalb sich Pole ausbilden.
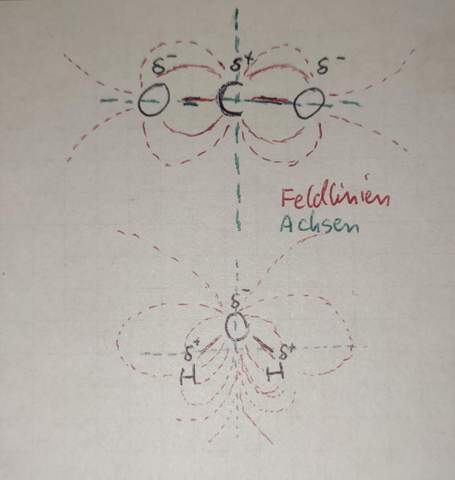
Eigentlich solltest du so die Frage, nach polar und unpolar mit diesen Informationen selber beantworten können. Ich hoffe ich konnte helfen.

Vielen, vielen Dank! Ich glaube, ich habe es jetzt tatsächlich verstanden

Nicht böse gemeint, aber bevor ich jetzt hier die Lösung reinschreibe: Wenn du so eine Frage stellst, ist es immer gut, wenn du noch dazu schreibst, was du selbst dazu denkst. Sonst kommen wir uns hier immer vor als würden wir einfach nur die Lösungen hinklatschen ohne dass wirklich was an "Lerneffekt" da ist. Schaut halt einfach besser aus dann.

Gut also zum Thema Dipol. Theoretisch betrachtet können nur Bindungen zwischen den gleichen Elementen keinen Dipol haben bzw. eine wirklich unpolare Bindung sein. In der Praxis ist es aber sinnvoll zu sagen, dass ab einer EN Differenz von 0,4 bis 1,7 Dipole vorhanden sind. Alles was kleiner ist, sind unpolare Bindungen, alles größer sind Salze.
Bei Ammoniak hast du drei N-H Bindungen mit einer EN Differenz von 0,8. Also eine polare Bindung. Ob ein Molekül nun nach außen hin als Dipol erscheint hängt davon ab, ob die Ladungsschwerpunkte der einzelnen polaren Bindungen zusammenfallen oder nicht bzw. dadurch ein permanentes Dipolmoment möglich ist. Bsp: HCl: Der positive Ladungsschwerpunkt liegt auf dem Wasserstoffatom, der negative auf dem Cl. Ergo ist es nach außen hin ein Dipol. 2. Bsp: CCl4. 4 polare Bindungen, aber die negativen Ladungsschwerpunkte der Cl Atome gleichen sich durch die Anordnung so aus, dass sie auf dem C zusammenfallen. Das heißt der positive und negative Schwerpunkt liegen genau am selben Punkt. CCl4 ist also trotz seine vier polaren Bindungen ein insgesamt unpolares Molekül.
Was denkst du wird davon beim Ammoniak der Fall sein?

Also ich würde sagen, der negative Ladungsschwerpunkt liegt beim Stickstoff?

ich bin so dumm in Chemie, es tut mir wirklich leid, dass ich deine Zeit so verschwende :/

Keine Sorge, dafür sind wir da :D
Wenn Ammoniak ein planares (also flaches) Molekül dann hättest du recht. Es ist aber trigonal pyramidal geformt (quasi wie Wasser mit einem H mehr). Also so:
https://de.cleanpng.com/png-nsqlp2/
Das heißt der negative Schwerpunkt liegt im Stickstoff, der positive der Hs aber etwas darunter. Das heißt es gibt ein permanentes Dipolmoment. Das Ammoniak-Molekül hat also einen Dipol.
Das mit den Schwerpunkten kannst du dir so vorstellen wie man es hier auf der rechten Seite beim Wasser sieht, nur halt mit dem dritten H noch dazu https://de.wikipedia.org/wiki/Elektrisches_Dipolmoment

Alles gut. Ich bin mir nicht sicher, aber ich hätte gedacht: (Ammoniak: unpolare atombindung, kein dipol); Moleküle haben den gleichen Elektronennegativitätswert, deswegen ist die atombindung unpolar) aber ich weiß nicht ob die einen dipol haben oder nicht