polare/unpolare Atombindung?
Ab wann spricht man von einer polaren und wann von einer umpolaren Atombindung?
2 Antworten

Unpolar sind immer zwei gleiche, polar sind solche mit unterschiedlicher Elektro-Negativität.
http://www.chemie-interaktiv.net/ff.htm
Guck mal da unter Periodensystem (ziemlich weit unten, dann auf Start), da kannst Du ach die EN einschalten, dann siehst Du genau, in welche Richtung die EN steigt und in welche sie fällt.
Grob gesagt (ist ja auch logisch!):
- Je mehr Elektronen in der äußeren Schale sitzen, desto negativer ist das.
- Je dichter die Elektronen am Kern sitzen, als weniger Schalen da sind (sie werden dann mehr von den Protonen angezogen), desto kleiner ist die EN.
- Und in einer Bindung guckst Du Dir die beiden Partner an und vergleichst, wo sie im PSE stehen, dann siehst Du ja, welches Atom mehr EN besitzt.
Wenn beide gleich sind, sind sie unpolar.
Wenn beide die gleiche EN haben, sind sie auch unpolar.
Wenn sie ähnlich sind auch, das kann man meist vernachlässigen.


Polare Bindungen entstehen wenn zwei Atome stark unterschiedliche Elektronegativitätswerte besitzen und eins dementsprechend stärker angezogen wird. (Siehe z.B. Wassermolekühle)
Unpolare Bindungen sind unter Anderem die "normalen" Elektronenpaarbindungen bei denen die Elektronegativitätswerte nur leicht unterschiedlich sind. (Siehe z.B. Wasserstoffmolekühle)
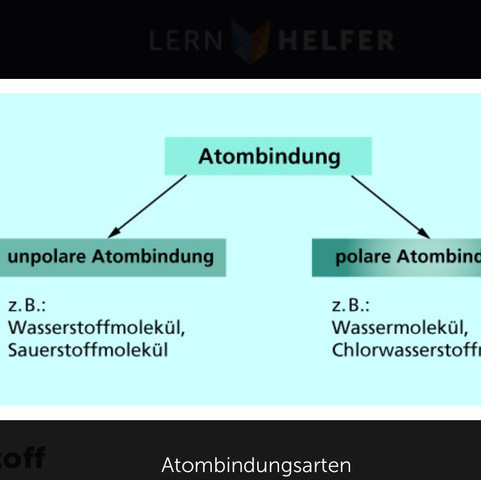

Wasserstoffmoleküle? Du meinst H2? Logisch, immer wenn zwei gleiche Atome nebeneinander sind, ist die Bindung unpolar. Weil die beiden Atome genau dieselbe EN haben - sie sind nicht "leicht unterschiedlich"!
Weil Wasser so häufig ist, würde ich dsa polare als normal bezeichnen.
Und Molekül bitte nicht mit "h".