Oxidation o. Reduktion?
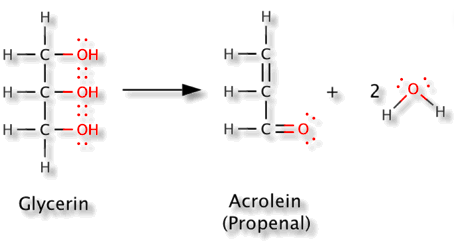
Handelt es sich bei der Umwandlung um eine Oxidation oder Reduktion? mfg
3 Antworten

Die oberen beiden C's werden um je eine Stufe reduziert; das untere wird um zwei Stufen oxidiert. Im Mittel ändert sich nichts.

Es ist zweifelhaft, ob man das als Redoxreaktion betrachten soll, d.h., ob man hier überhaupt von Oxidation und Reduktion sprechen kann.
Wenn man mit den üblichen Regeln die Oxidationszahlen ausrechnet dann kommt man sowohl auf der Produkt- als auch auf der Eduktseite −II für den Sauerstoff und +I für den Wasserstoff heraus. Beim C ist es komplizierter: Im Glycerin haben die Kohlenstoffatome von oben nach unten die Oxidationszahlen −I, 0 und −I, im Acrolein −II, −I und +I.
Wenn man das also als Redoxreaktion betrachten will, dann ist es also eine intramolekulare Disproportionierung: Die zwei oberen C-Atome sind das „Oxidationsmittel“, mit dem das untere oxidiert wird.
Aber besonders sinnvoll ist das nicht. Das Beispiel ist eher gut dafür geeignet, zu erklären, warum Oxidationszahlen in der organischen Chemie nicht besonders nützlich sind. Aus den Oxidatioszahlen lernt man nichts über diese Reaktion, dazu braucht es andere Konzepte, z.B. Eiminierung, Konjugation, α,β-ungesättigt oder funktionelle Gruppe.

Ja, wenn man will, dann kann man das so sehen. Aber die Leute, die in Organischer Chemie arbeiten, sehen das gewöhnlich anders.
Vergiß nicht: Oxidationszahlen sind gänzlich künstlich, eine von Menschen erfundene Buchhaltungsgröße. Es gibt zwar eine Vorschrift, wie man sie aus einer Strukturformel berechnen kann, aber in der Realität sind sie nicht meßbar, weil sie nur in Büchern existieren, und nicht in der Natur. Man verwendet sie, wenn es sinnvoll und hilfreichist; aber es gibt keine Pflicht, sie zu berücksichtigen, wenn sie nichts oder wenig bringen.

Eine Redoxreakrion. Die C-Atome der Doppelbindung wurden reduziert, das untere Carbonyl-C-Atom dagegen oxidiert.
wie du oben gesagt hast, sind die oberen C Atome das "Oxidationsmittel" heißt das nicht automatisch, dass es eine Redoxreaktion ist? weil wo es eine Reduktion/Oxidation gibt, gibt es auch eine Oxidation/Reduktion, oder etwa nicht?