Lewisformel?
Hey, wieso ist die Lewisformel von N2O linear und vor allem woher weiß ich, dass die beiden N mit einander verbunden sind und nicht das O in der Mitte ist? Über eine Antwort wäre ich sehr dankbar :)
3 Antworten

Das kannst du dir so überlegen. Für gewöhnlich geht Sauerstoff 2 Bindungen und Stickstoff 3. Wenn du jetzt das O in die Mitte setzt, kannst du zu jedem N eine Bindung bilden. Dass das den N nicht so wirklich gefällt, sollte klar sein. Es muss also ein N in der Mitte sein.
Für die Bindungen zwischen den Atomen hast du jetzt folgende Möglichkeiten:
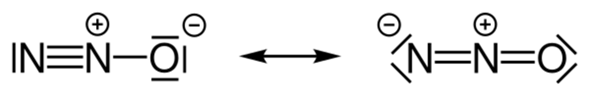
Das nennt sich Mesomerie. Die "wahre" Bindungssituation liegt irgendwo dazwischen. Das ist auch gleichzeitig die Erklärung, warum das Molekül linear ist. In der rechten Struktur liegen im Molekül zwei Doppelbindungen vor und die kann man nicht knicken. Die drei Atome müssen also auf einer Linie liegen, um diese Struktur bilden zu können.

Ja, das Prinzip ist ähnlich wie beim CO2. In dem Fall hast du halt 2 N und ein O. Die musst du ja verteilen und mit Bindungen bzw Elektronen absättigen. Das O kann ja auch 3 Bindungen bilden (siehe H3O+). Wenn du es jetzt in die Mitte packst, ist das höchste der Gefühle sowas hier:
||N=O-N|||
Die | sollen die freien Elektronenpaare darstellen die noch nötig wären. Das heißt, am linken N hättest du jetzt eine Ladung von -1 und am rechten von -2. Das O wäre einfach positiv geladen. Und du hast ganz schön viele freie Elektronenpaare. Dass das so nicht besonder stabil ist, ist denk ich klar. Zumal dieses Molekül ja auch eine Gesamtladung von -2 haben müsste, die es ja aber nicht hat. Geht also nicht auf, das ganze.

Ich hatte es erst gewinkelt dargestellt mit dem O in der Mitte und jeweils eine Einfachbindung zu den beiden N. Dann gab es überall 2 freie Elektronenpaare, aber ich denke mein "Hauptfehler" war es, nicht direkt zu erkennen, dass es linear sein muss. Mit der Tatsache, erscheint es mir auch logischer, dass ein N in der Mitte ist, damit es stabiler wird. Also hast du evtl noch einen Tipp, wie ich sofort weiß, dass es linear oder eben nicht linear ist?

Wenn du ein O in die Mitte machst und 2 freie Elektronenpaare an die Ns, dann fehlen denen jeweils 2 Elektronen. Die haben ja dann nur 6 und nicht 8.
Wie gesagt, das ergibt sich durch die Struktur. Dadurch, dass du N=N=O hast, muss es linear sein. Du kannst ja zwei direkt aufeinander folgende Doppelbindungen nicht knicken. Siehe CO2 oder auch Alkene mit -C=C=C- Bindung. N2O ist übrigens isoelektronisch zu CO2. Daher kann man auch von einer analogen Struktur ausgehen. (Isoelektronisch heißt, dass zwei Moleküle gleich viele Atome, Elektronen und Elektronenkonfiguration besitzen)

Moin,
das hat unter anderem etwas mit der Frage zu tun, warum sich Atome verschiedener Elemente überhaupt miteinander verbinden. Die folgende Antwort fällt leider etwas umfangreich aus, weil hier einige Dinge verstanden sein wollen. Wenn du keine Lust hast, dass alles zu lesen, schau auf das Fazit ganz unten...
Der erste Schlüssel zur Antwort auf diese Frage, warum sich Atome überhaupt miteinander verbinden, liegt in der Betrachtung der Atome von Edelgasen.
Edelgase verdanken die Bezeichnung ihrer Gruppe dem Umstand, dass sie praktisch so gut wie keine stabilen Verbindungen mit Atomen anderer Elemente eingehen. Sie sind quasi „zu edel” dafür. Die paar Edelgasverbindungen, die es gibt, sind entweder nur mit Elementen möglich, die seeehr interessiert an Elektronen sind (Fluor, Sauerstoff) und / oder diese Verbindungen sind nur unter extremen Bedingungen einigermaßen stabil (zum Beispiel bei seehr niedrigen Temperaturen).
Faustregel: Für Schulzwecke kannst du dir vereinfacht merken, dass Edelgasatome praktisch keine (stabilen) Verbindungen eingehen.
Aber warum ist das so? - Nun, das liegt wiederum daran, dass Edelgasatome eine Anzahl und Verteilung von Elektronen in ihrer Hülle haben, die von der Energie her gesehen (energetisch) perfekt sind.
Jede chemische Reaktion, die zu einer chemischen Verbindung führt, verändert aber die Hülle der beteiligten Atome.
Das bedeutet für Edelgasatome, dass in ihren perfekten Hüllen jede Veränderung zu einem weniger perfekten Zustand führen würde. Deshalb reagieren Edelgasatome weder untereinander noch mit den Atomen anderer Elemente, verstehst du?
Die Atome aller anderen Elemente haben dagegen Hüllen, in denen die Anzahl und Verteilung der Elektronen nicht ganz so perfekt sind. Deshalb reagieren sie miteinander, weil sie durch die Veränderungen in ihren Hüllen einen Zustand erreichen wollen, wie ihn Edelgasatome von Natur aus haben. Das heißt, sie streben durch eine chemische Reaktion in ihrer Hülle einen Edelgaszustand an.
Besonders wichtig ist dabei das äußere Hauptenergieniveau (die Außenschale) der Atomhülle. Die allermeisten Atome wollen in dieser äußeren Schale auf acht Elektronen kommen (Oktettregel). Das liegt daran, dass fast alle Edelgasatome ebenfalls diese acht Außenelektronen haben. (Einzige Ausnahme ist Helium, He, das schon mit zwei Elektronen vollkommen glücklich ist; entsprechend gibt es nur wenige Atome, für die das auch gilt, nämlich Wasserstoff, H2, Lithium, Li oder Beryllium, Be).
So! - Wenn du das verstanden und akzeptiert hast, können wir uns deinem Problem widmen.
Wenn du die im Lachgas (N2O) beteiligten Atome (Stickstoff und Sauerstoff) in der Lewisschreibweise darstellst, dann sieht das folgendermaßen aus:
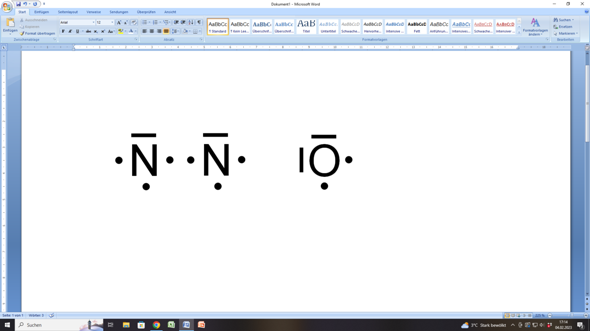
Das Stickstoffatom hat insgesamt fünf Außenelektronen. Drei davon sind einzeln, also ungepaart (einzelne Punkte), die sich hier links, rechts und unter dem Elementsymbol (= Atomrumpf) befinden. Über dem Symbol siehst du noch einen Strich, der ein Elektronenpaar (also zwei Elektronen, die in einem Orbital gepaart sind) darstellt. Das macht zusammen 3 (einzelne, ungepaarte) + 2 (gepaarte) = 5 Elektronen.
Entsprechend hat ein Sauerstoffatom zwei Elektronenpaare (zwei Striche) und zwei ungepaarte Elektronen (einzelne Punkte). Das macht zusammen 2 x 2 (gepaarte) + 2 x 1 (ungepaarte) = 6 Elektronen.
Um nun auf die acht Außenelektronen für einen Edelgaszustand kommen zu können, brauchen die Stickstoffatome jeweils noch drei Elektronen, während das Sauerstoffatom nur zwei weitere Elektronen benötigt.
Da beide Atomsorten Elektronen benötigen (also aufnehmen wollen), aber keines welche abgeben will, können sie sich nicht mit Hilfe einer Elektronenübergabe (Ionenbildung) helfen. Sie müssen vielmehr versuchen, durch die Bildung von bindenden Elektronenpaaren zwischen ihren Atomrümpfen einen Zustand zu erreichen, in denen die bindenden Elektronenpaare von beiden Atomrümpfen gleichzeitig beansprucht werden können.
Nun versuchen wir es mit deinem Vorschlag, dass das Sauerstoffatom zwischen den beiden Stickstoffatomen liegt:
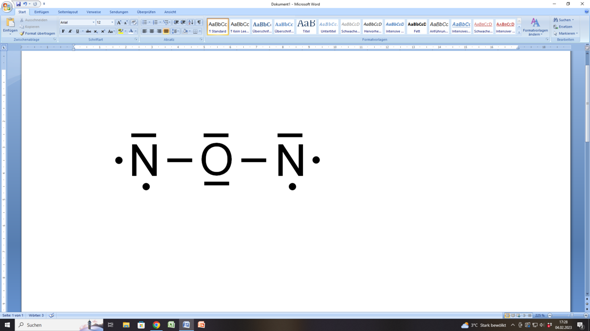
Hier käme das Sauerstoffatome auf acht Außenelektronen (= Edelgaskonfiguration), denn es hätte 2 bindende Elektronenpaare (eine zu jedem Stickstoffatom) und 2 freie (nicht-bindende) Elektronenpaare, was zusammen acht Elektronen ergibt.
Aber die beiden Stickstoffatome kämen nicht zu einer Edelgaskonfiguration, weil jedes von ihnen ein bindendes Elektronenpaar (zum Sauerstoffatom), ein freies (nicht-bindendes) Elektronenpaar sowie zwei einzelne (ungepaarte) Elektronen hätte. Das wären nur sechs Elektronen, aber eben keine acht!
Deshalb brächte das den Stickstoffatomen nichts.
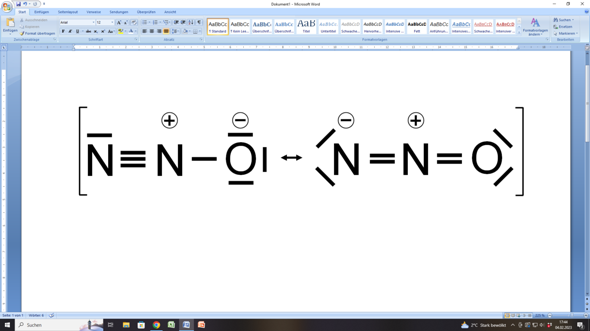
Darum lautet die Lösung:
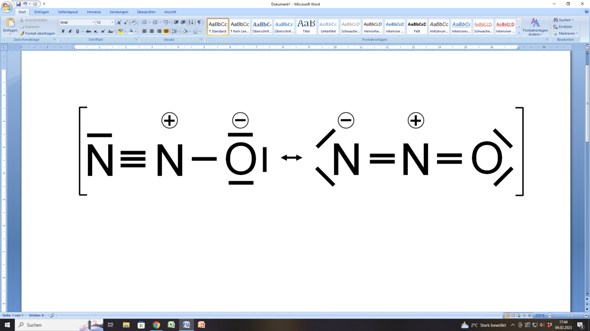
Das eine Stickstoffatom ist mit dem anderen verbunden, wobei das mittlere Stickstoffatom außerdem noch mit dem Sauerstoffatom verbunden ist.
Wenn du jetzt für jedes beteiligte Atom die Außenelektronen zählst, kommst du jedes Mal auf acht, also immer auf eine Edelgaskonfiguration.
Im linken Teil der Abbildung hat das Stickstoffatom links 1 freies Elektronenpaar plus drei bindende Elektronenpaare, was zusammen (2 + 6 =) 8 Elektronen ergibt.
Das mittlere Stickstoffatom hat ebenfalls drei bindende Elektronenpaare zum anderen Stickstoffatom sowie ein weiteres bindendes Elektronenpaar zum Sauerstoffatom. Das macht zusammen (6 + 2 =) 8 Elektronen.
Und auch das Sauerstoffatom hat hier acht Elektronen, ein bindendes Elektronenpaar plus drei freie, was (2 + 6 =) 8 Elektronen ergibt.
In der rechten Hälfte der Abbildung sind die Bindungsverhältnisse etwas anders, aber dennoch bleibt es dabei, dass auch hier alle beteiligten Atome auf acht Außenelektronen und somit auf eine Edelgaskonfiguration kommen.
Stör dich nicht an den Ladungen im Kreis, die an den Stickstoffatomen bzw. am Sauerstoffatom stehen. Das sind sogenannte Formalladungen. Sie ergeben sich dann, wenn nach einer (gedachten) Aufteilung von Bindungselektronen der Vergleich der Elektronenanzahl nicht mit der Anzahl eines ungebundenen Atoms übereinstimmt.
Beispiel: Wenn du im linken Teilbild die drei bindenden Elektronenpaare zwischen den Stickstoffatomen und das eine bindende Elektronenpaar zwischen dem mittleren Stickstoffatom und dem Sauerstoffatom gerecht aufteilst, dann würde der linke Stickstoff auf fünf Außenelektronen kommen, gerade so viele, wie es auch ein ungebundenes Stickstoffatom hätte (siehe ganz oben).
Wenn du das aber beim mittleren Stickstoffatom nachzählst, kämst du hier nur noch auf vier Außenelektronen (3 + 1 = 4). Das heißt, dass dieses Stickstoffatom nach der Verteilung im Vergleich mit einem ungebundenen Stickstoffatom ein Elektron weniger hätte. Da ein Elektron ein negativer Ladungsträger ist, fehlt dem mittleren Stickstoffatom formal eine negative Ladung. Es ist dann (gedacht) so, als hätte dieses Stickstoffatom ein Elektron abgegeben. Deshalb erhält es eine positive Formalladung.
Umgekehrt hätte in diesem Teilbild das Sauerstoffatom nach der Aufteilung der Elektronen insgesamt sieben Elektronen (6 aus den drei freien Elektronenpaaren und 1 aus dem bindenden Elektronenpaar). Im Vergleich mit einem ungebundenen Sauerstoffatom hat es nach der Aufteilung also ein Elektron mehr. Deshalb trägt der Sauerstoff eine negative Formalladung, verstehst du?
Wir sind fast am Ende der ausführlichen Erklärung.
Du wolltest ja auch noch wissen, woher du wissen sollst, dass die Geometrie des Moleküls linear ist.
Das könnte man mit dem Kugelwolkenmodell des Atombaus sofort verstehen. Aber es würde zu weit führen, das hier mal kurz auch noch zu erklären.
Doch was du dir merken kannst, ist, dass in Lewisformeln eine Dreifachbindung immer zu einer linearen Geometrie im betroffenen Molekülabschnitt führt. Gleiches gilt auch für kumulierte Doppelbindungen (also wenn ein Atom zwei Doppelbindungen ausbildet).
Und egal, welche der beiden Grenzstrukturen du beim Distickstoffmonoxid zugrunde legst, immer trifft eine dieser beiden Regeln zu. Im linken Teil der Abbildung befinden sich zwischen den beiden Stickstoffatomen eine Dreifachbindung, was eine lineare Geometrie ergibt, während im rechten Teil der Abbildung vom mittleren Stickstoffatom zwei Doppelbindungen ausgehen, so dass auch hier eine lineare Geometrie resultiert.
Fazit:
- Atome verbinden sich, weil sie in ihren Hüllen eine Edelgaskonfiguration erreichen wollen.
- Das bedeutet in den meisten Fällen, dass sie auf acht Außenelektronen kommen müssen.
- Deshalb geht im Falle des Lachgases die Anordnung N–O–N nicht.
- Wenn die gebundenen Atome auf acht Außenelektronen kommen, ist es ihnen völlig egal, ob sie dafür eine echte oder eine formale Ladung in Kauf nehmen müssen; Hauptsache Edelgaskonfiguration!
- Molekül(abschnitt)e mit Dreifachbindungen sind linear gebaut.
- Molekül(abschnitt)e mit kumulierten Doppelbindungen sind ebenfalls linear gebaut.
Darum geht nur NNO, was ein lineares Molekül ergibt...
LG von der Waterkant
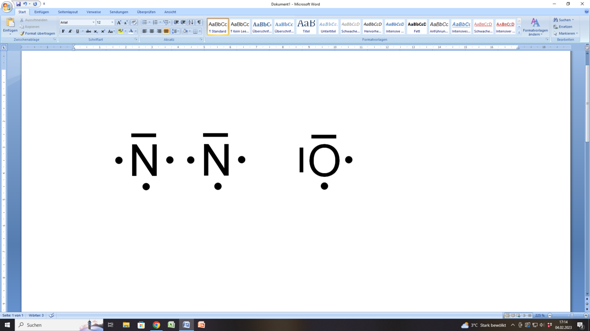
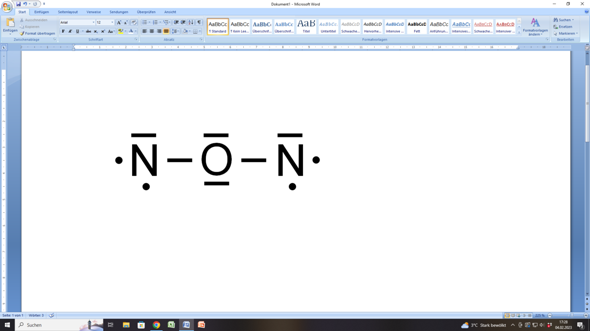

Die Lewisformel von N2O ist linear, weil es ein Molekül mit gerader Symmetrie ist. Da N und O unterschiedliche Elekronegativitäten haben, zieht das zentrale O-Atom die Elektronenpaare im N-N-Bindungsbereich stärker an und verursacht somit eine polarisierte Bindung.
In der Lewisformel stellen die Punkte oder Kreise die Valenzelektronen dar und die Bindungen zwischen den Atomen stellen die Bindungs-Elektronenpaare dar. Da in N2O das zentrale O-Atom 4 Valenzelektronen hat und das Bindungs-Elektronenpaar mit den beiden N-Atomen teilt, zeigt die Lewisformel eine gerade Anordnung von 2 N-Atomen und 1 O-Atom.
Die spezifische Anordnung der Atome in der Lewisformel (N-N-O oder N-O-N) ist nicht von Bedeutung, solange die Anzahl und Anordnung der Valenzelektronen und Bindungen korrekt dargestellt werden. Es gibt jedoch verschiedene Konventionen für die Anordnung der Atome in Lewisformeln, die oft die Symmetrie und Elektronegativitätsunterschiede der Atome berücksichtigen.

Was meinst du genau mit "linearer Symmetrie"? Wie erkenne ich das?
Echt? Ich finde nur Lösungen mit N-N-O, aber nicht N-O-N und dachte, meins wäre deswegen falsch?

Mit "linearer Symmetrie" meine ich, dass die Atome eines Moleküls in einer geraden Linie angeordnet sind. In einem linearen Molekül gibt es eine eindeutige Spiegelachse, entlang der die beiden Hälften des Moleküls übereinstimmen.
Ein Weg, um die Symmetrie eines Moleküls zu bestimmen, ist, ein 3D-Modell des Moleküls zu betrachten und nach einer Achse zu suchen, entlang der die beiden Hälften des Moleküls spiegelbildlich übereinstimmen.
In Bezug auf die Lewisformel von N2O gibt es keine falsche Darstellung, solange die Anzahl und Anordnung der Valenzelektronen und Bindungen korrekt sind. Einige Chemiker bevorzugen die Anordnung N-N-O, um die Elektronegativitätsunterschiede zwischen N und O zu betonen. Andere Chemiker bevorzugen die Anordnung N-O-N, um die lineare Symmetrie des Moleküls hervorzuheben. Beide Darstellungen sind korrekt.

Hör nicht auf den, der hat wieder nur von ChatGPT abgeschrieben. In der Antwort stimmt quasi nichts

Er meint nichts genaues, außer seinen Senf dazugeben zu müssen.



Hast du das selbst erfunden oder erfinden lassen? Ist jedenfalls Unfug.

Moin,
sorry, aber deine Antwort ist nicht hilfreich. Das liegt zum Teil daran, dass du Aspekte einbringst, die damit nichts zu tun haben (Elektronegativität). Zum Teil liegt es daran, dass du einem Zirkelschluss unterliegst (sinngemäß: es ist linear, weil es eine 180°-Geometrie hat; das erklärt nichts, sondern nutzt zwei Synonyme). Und in wieder einem Teil deiner Antwort liegst du einfach falsch. Es gibt im Lachgasmolekül kein zentrale Sauerstoffatom! Und der letzte Abschnitt ist völlig absurd.
@ mathe999:
Vergiss diese Antwort!
Erstmal vielen Dank! Ja, wenn es so gezeichnet ist, verstehe ich die Linearität. Nur leider ist mir der Teil, weshalb ein N in der Mitte ist, noch unklar. Bei CO2 bspw ist ja auch das C in der Mitte, ich finde das irgendwie "intuitiver". Aber ist das N jetzt in der Mitte, weil es mehrbindiger ist als das O und so auf beiden Seiten Bindungen eingehen kann ansatt nur auf einer, wenn das O in der Mitte ist?