kann mir jmd bei der redoxgleichung helfen?
Fe2O3+ 2Al —> 2Fe + Al2O3
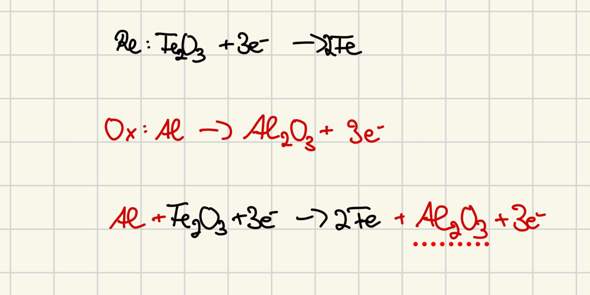
also ich merke ja selbst dass das so nicht klappen kann aber ich finde den fehler nicht
3 Antworten

Hi,
es hilft bei solchen Reaktionsgleichungen, sich ein Vorgehen zu überlegen, das man minutiös abarbeitet. Dann passieren einem seltener Fehler.
Wir wissen, dass Eisen(III)-oxid und Aluminium zu Aluminiumoxid und Eisen reagieren und erhalten als unausgeglichene Reaktionsgleichung:
Fe2O3 + Al --> Al2O3 + Fe.
Um das Ausgleichen kümmern wir uns noch. Als nächsten Schritt schaust du: In welchen Verbindungen kommt beides Mal was mit Eisen und was mit Aluminium vor? Für Eisen hast du links Fe2O3, rechts Fe (also das reine Element). Wir wissen, dass Eisen hier die Ladung 3+ hat. Rechts hat Eisen die Ladung 0, denn Elementatome haben keine Ladung. Den Sauerstoff können wir vernachlässigen, da er sowohl links als auch rechts 2- als Ladung hat und mit dem somit nicht sonderlich viel passiert. Deshalb kannst du auch einfach Fe(3+) bzw. Al(3+) schreiben - das macht das Ausgleichen wesentlich leichter.
Beim Aluminium hast du links das neutrale Aliminium und rechts in der Ladung 3+ (im Aluminiumoxid). Wir wissen also erstmal nur:
Fe(3+) --> Fe
Al --> Al(3+).
Aluminium gibt, um auf Al(3+) zu kommen, seine drei Valenzelektronen ab. Wir können also 3e(-) schreiben, denn das sind genau diese drei Elektronen. Wenn Elektronen abgegeben werden, kommen sie auf die rechte Seite. Werden Elektronen aufgenommen, kommen sie auf die linke Seite, das hast du ja bereits richtig gemacht. Wir wissen für die Teilgleichung mit dem Aluminium also:
Al --> Al(3+) + 3e(-).
Die Gleichung für die Oxidation ist also fertig. Für Eisen muss es nun umgekehrt sein: Wenn Aluminium die Elektronen abgibt, muss Eisen diese aufnehmen. Wir können ja nicht einfach unreagierte Elektronen im Reaktionsgemisch haben. Du siehst in der Teilgleichung für Eisen, dass die Zahl von 3+ auf 0 sinkt. Es braucht also auch genau diese drei Elektronen, die das Aluminium abgibt:
Fe(3+) + 3e(-) --> Fe.
Hier haben wir das Glück, dass wir nicht ausgleichen müssen. Wir haben sowohl in der Reduktion als auch in der Oxidation schon drei Elektronen. Es gibt Reaktionen, wo z. B. zwei Elektronen abgegeben werden aber drei Elektronen aufgenommen. Da musst du dann schauen, dass du die Gleichungen so multiplizierst, dass die Anzahl der abgegebenen Elektronen der Anzahl der aufgenommenen Elektronen entspricht.
Diese Gleichungen kannst du jetzt zu einer RedOx-Gleichung zusammenführen. Diese tun wir, indem wir alle Edukte addieren und alle Produkte ebenfalls:
Fe(3+) + 3e(-) + Al --> Fe + Al(3+) + 3e(-).
Auf beiden Seiten stehen noch Elektronen. Die können wir streichen, da wir auf beiden Seiten jeweils drei Elektronen haben:
Fe(3+) + Al --> Fe + Al(3+).
Das ist auch der Grund, warum du das manchmal noch durch Multiplikation anpassen musst, wenn die Anzahl der abgegebenen und aufgenommenen Elektronen sich unterscheiden: Wir wollen am Ende links und rechts dieselbe Anzahl an Elektronen haben, damit wir die rausstreichen können.
In der Gesamtgleichung mit Sauerstoff stehen ja noch lauter Zweien in den Indizes (also als tiefgestellte Zahlen). Das liegt daran, dass wir jetzt nur die Redoxgleichungen für die Metallionen aufgestellt haben. In der Gesamtgleichung vom Anfang haben wir aber Fe2O3 und Al2O3. Da in Fe2O3 zwei Eisenionen stecken, kommen rechts natürlich zwei Eisenatome raus. Dasselbe gilt für Aluminium. Wenn du aber zwei Eisenionen hast, brauchst du auch doppelt so viele Elektronen, die die Ionen aufnehmen müssen. Dasselbe gilt umgekehrt für Aluminium: Bei zwei Aluminiumatomen brauchst du 6 Elektronen. Das heißt, wir könnten jetzt schreiben:
2 Al --> 2 Al(3+) + 6e(-)
2 Fe(3+) + 6e(-) --> 2 Fe.
Das Sauerstoff macht eigentlich gar nichts an der Reaktion. Würde man ihn dazu schreiben, hätte man:
2 Al + 3 O(2-) --> 2 Al(3+) + 6e(-) + 3 O(2-)
2 Fe(3+) + 3 O(2-) + 6e(-) --> 2 Fe + 3O(2-).
Unsere Gesamtlösung ist also, als Verbindungen ausgeschrieben und gekürzt:
Fe2O3 + 2 Al --> Al2O3 + 2 Fe.
Wenn du noch Fragen hast, dann melde dich.
LG

Oh, danke für das Kompliment, freut mich, dass ich dir helfen kann! :)
Klar, für Aluminium und Sauerstoff selbst könntest du auch eine eigene Redox Gleichung aufstellen:
Ox: 4 Al ---> 4 Al(3+) + 12 e(-)
Red: 3 O2 + 12 e(-) --> 6 O(2-)
Redox: 4 Al 3 O2 --> 2 Al2O3
Zu deiner Kupfer-Eisen-Sache: Da ist dir ein Fehler unterlaufen. Und zwar gibt Eisen Elektronen ab (es ist ja eine Oxidation):
2 Fe + 3 O(2-) --> 2 Fe(3+) + 6e(-) + 3 O(2-)
Die Kupfer-Teilgleichung stimmt.
Es ergibt sich also gesamt:
3 Cu(2+) + 3 O(2-) + 2 Fe --> 3 Cu + 2 Fe(3+) + 3 O(2-)
bzw.
3 CuO + 2 Fe --> 3 Cu + Fe2O3.



links und rechts vom Reaktionspfeil sollten die gleiche Anzahl von Teilchen stehen.
red: Fe2O3 + 6 e- ---> 2 Fe + 3 O²-
Ox: 2 Al ---> 2 Al³+ + 6 e-
Die Anzahl der Elektronen muss bei Red. und Ox gleich sein. Nur bei Eisen ändert sich die Oxidationszahl. Zur Sicherheit kann man die darüber schreiben.
Die Reaktionsprodukte bilden Al2O3

Da ist nicht nur ein Fehler drin. Lass den Sauerstoff erstmal weg, das scheint dich nur noch mehr zu verwirren. Vor allem musst du aber anfangen, die Gleichungen vernünftig auszugleichen. Also:
Fe^3+ + 3 e^- -> Fe
und
Al -> Al^3+ + 3 e^-
Das jetzt auf die Oxide anpassen. Dafür zunächst verdoppeln, weil du ja jeweils 2 Metallionen pro Oxid hast
2 Fe^3+ + 6 e^- -> 2 Fe
2 Al -> 2 Al^3+ + 6 e^-
Wahlweise den Sauerstoff dazu (der ja nichts macht, also auf beiden Seiten einfach dasselbe schreiben, nämlich 3 O^2-)
2 Fe^3+ + 3 O^2- + 6 e^- -> 2 Fe + 3 O^2-
2 Al + 3 O^2- -> 2 Al^3+ + 6 e^- + 3 O^2-
Dann zu den Oxiden zusammenfassen:
Fe2O3 + 6 e^- -> 2 Fe + 3 O^2-
2 Al + 3 O^2- -> Al2O3 + 6 e^-
Und daraus dann die Gesamtgleichung schreiben. Den Schritt mit dem Sauerstoff kann man sicher aber eigentlich sparen und ihn einfach weglassen, weil der weder oxidiert noch reduziert wird.

kürzt man jetzt die 3O2? Fe2O3 +6 e- + 2 Al + 3 O2 —> 2 Fe + 3 O2- + Al2O3 + 6e-
weil so würde es ja nicht stimmen da ist viel zu viel 3 O2 oder?

Die übrigen 3 O^2- werden genauso wie die Elektronen für die Gesamtgleichung gekürzt, ja. Wenn links und rechts dasselbe steht, fliegt das raus.

würde es bei CuO +Fe dann so aussehen?
3 Cu + 3 O2- + 6e- + 2Fe —> 2 Fe 3+ + 3 O2- + 3e-+ 3Cu

Nein. Kupfer hat bei dir wieder keine Ladungen. Außerdem schreibst du links 6 Elektronen, rechts nur 3. Elektronen schreibt man auch nur in den Teilgleichungen, die haben in so einer Gesamtgleichung nichts verloren, weils dann zu viele wären.
Die Gleichungen wären:
Red: Cu^2+ + 2 e^- -> Cu
Ox: Fe -> Fe^3+ + 3 e^-
Die musst du wieder angleichen, sodass es gleich viele Elektronen bei beiden sind. Also:
Red: 3 Cu^2+ + 2 e^- -> 3 Cu
Ox: 2 Fe -> 2 Fe^3+ + 6 e^-
Gesamt: 3 Cu^2+ + 2 Fe -> 3 Cu + 2 Fe^3+


Ja den kannst du ja einfach ergänzen. Aber da der nichts macht, braucht man den nicht unbedingt.
Das wäre dann
Red: 3 CuO + 2 e^- -> 3 Cu + 3 O^2-
Ox: 2 Fe + 3 O^2- -> Fe2O3 + 6 e^-
Gesamt: 3 CuO + 2 Fe -> 3 Cu + Fe2O3


Und weil mir das grade so auffällt, in den Reduktionsgleichungen müsste selbstverständlich 6 e^- stehen. Das hab ich übersehen.
Deine Erklärungen verstehe ich immer am besten! mein problem war nicht dass ich das grundprinzip der redoxgleichungen nicht verstehe sondern wie es ist wenn ein Partner abgegeben wird wie hier das O2. Also funktionieren solche Reaktionen ganz normal wie zb Al + O2. Und nur damit ich es richtig verstanden habe
Red: Cu2+ 2e- +O2- —> Cu + O2- \ •3
3 Cu 2+ + 6e- + 3 O2- —> 3Cu+ 3 O2-
Ox: Fe + 3e- —> Fe3- + 3O2- /• 2
2 Fe+ 6e- —> 2Fe3-+ 3O2-
wäre das so richtig?