Gas durch isobare Abkühlung verflüssigt?
weiß jemand, Welche Voraussetzungen müssen erfüllt sein, damit ein Gas durch isobare Abkühlung und durch isotherme Kompression verflüssigt werden kann ?
4 Antworten

Eine flüssige Phase kann nur unterhalb der kritischen Temperatur existieren. Isotherme Kompression kann also nur dann zur Flüssigkeit führen, wenn die Temperatur tief genug liegt — O₂ und N₂ haben kritische Temperaturen unterhalb von −100 °C, also kann man Luft bei Raumtemperatur durch isotherme Kompression niemals verflüssigen, sondern erhält nur immer dichteres Gas.
Isobare Abkühlung führt immer zur Bildung einer kondensierten Phase, denn bei hinreichend tiefen Temperaturen kann kein Stoff als Gas existieren. Ob aber ein Gas oder eine Flüssigkeit herauskommt, hängt vom Druck ab, weil Flüssigkeiten nur bei einem Druck oberhalb des Tripelpunktdruckes existieren können. Wenn der Anfangsdruck zu niedrig ist, entsteht beim Abkühlen direkt ein Festkörper.

Grundsätzlich lautet jede Gleichgewichtsbedingung, daß jede Komponente in jeder Phase dasselbe chemische Potential haben muß. Im Fall eines flüssig/gasförmig-Gleichgewichts (wenn Du das meinst) läuft das darauf hinaus, daß der Dampfdruck der Flüssigkeit genau dem Druck in der Gasphase entsprechen muß.

Diese Fragen lassen sich am besten anhand eines Phasendiagrammes beantworten.
Hier das Phasendiagramm von CO2:
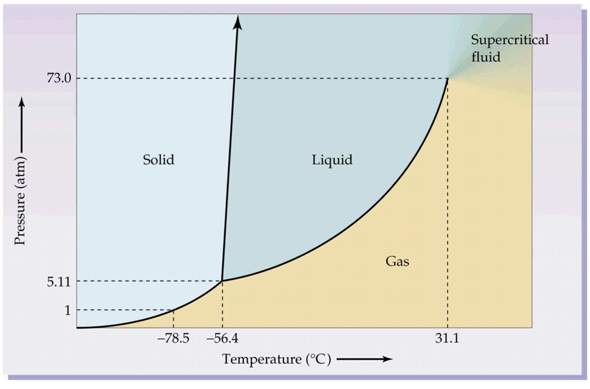
Um von "Verflüssigen" reden zu können, müssen wir im Flüssigkeitsgebiet landen. Das bedeutet, wir müssen vom Druck her unterhalb des kritischen Punktes von 73 bar bleiben, aber über dem Druck des Tripelpunktes von 5,11 bar. Oberhalb von 73 bar würden wir nur ein überkritisches Gas durch Kompression erzeugen, unter 5,11 bar würde es zu einer Sublimation kommen.
Das wären also die Grenzen, um bei isobarer Abkühlung in die Flüssigkeitsphase gelangen zu können.
Bei der isothermen Kompression muss die Ausgangstemperaturzwischen -56,4 °C (Tripelpunkt) und 31,1 °C liegen. Ansonsten hätten wir wieder Sublimation oder ein überkritisches Fluid.
Um ein stabiles Zweiphasengemisch zu erhalten, muss sich der Zustand des Systems exakt auf einer der dick eingezeichneten Phasengrenzen befinden. Und nur exakt im Tripelpunkt könnte man ein stabiles 3-Phasengemisch erzeugen.

> damit ein Gas durch isobare Abkühlung
Du brauchst - je nach Gas - einen guten Kühlschrank. Bei He und Normalsruck musst Du auf 4 K runterkühlen.
> und durch isotherme Kompression
Die Temperatur muss kalt genug sein. Bei manchen Gasen geht es bei Raumtemperatur, bei manchen nicht. Damit es geht, muss die Temperatur gleich oder kleiner der am
https://de.wikipedia.org/wiki/Kritischer_Punkt_(Thermodynamik)
sein.


Die Zielbedingungen müssen unterhalb des kritischen Punktes liegen. Und falls dies erfüllt ist, natürlich unterhalb des Siedepunktes.
Danke ihnen sehr. Darf ich Sie auch fragen ob Sie Idee haben, Wie die Gleichgewichtsbedingung für ein Zweiphasengleichgewicht eines reinen fluiden Stoffes lautet ?