Fragen zu diesen Chemieaufgaben (brauche das für die Klausur)?
Hi,
ich schreibe demnächst eine Klausur im Fach Chemie. Unser Lehrer hat uns ein paar Beispielaufgaben gegeben; aber ich verstehe diese einfach nicht und brauche dringend Hilfe dabei.
Aufg. 3: Sorbit wird als Süßstoff verwendet. a)warum ist der Stoff fest? b) Erstellen sie die Reaktionsgleichung für die Verbrennung von Sorbit.
Aufg. 4: Sie haben 2 Flaschen, von denen sich die Etiketten gelöst haben. In einer Flasche ist 1-Butanol, in der anderen 2-Butanol. a)zeichnen sie die beiden Alkohole (die Aufgabe kann ich zwar, aber ich weiß nicht wie ich die Oxidationszahlen setzen soll). b) Welcher Alkohol befindet sich in welcher Flasche? Erläutern sie anhand von Reaktionsgleichung (mit Teilgl. Für Red. Und Ox.), wie sie die Alkohole zuordnen können.
Zudem gab es noch eine Aufgabe in welcher ich 3 Stoffe vorgegeben bekommen habe (Heptan, Dekan 1-ol und Ethan 1,2 diol) und diese nach Löslichkeit sortieren soll. Ich würde die Stoffe so sortieren: Ethan 1,2 diol (das löslichste), Dekan-1-ol, Heptan. Ich würde diese so sortieren, da die Stoffe mit den meisten OH Gruppen am löslichsten sind. Haben 2 Stoffe die gleiche Anzahl an OH Gruppen, ist das mit den weniger Kohlenstoffe das löslichere. (Es geht hierbei um die Wasserlöslichkeit). Ist meine Reihenfolge und dke Begründung richtig?
Vielen Dank für alle hilfreichen Antworten, ich bin echt verzweifelt bei diesen Aufgaben.
4 Antworten

Hey :)
Ich versuche dir mal zu helfen :)
Aufgabe 3
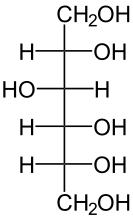
Sorbit ist erstmal ein Süßstoff. Sorbit gehört zu den Zuckeralkoholen. Es ist quasi aufgebaut wie Glukose, nur dass du am ersten C-Atom statt einer Aldehydgruppe (-CHO) eine Hydroxygruppe und zwei H-Atome (-CH2OH) hast. Die Struktur von Sorbitol ist wie folgt:
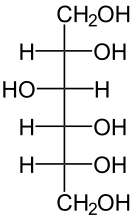
a) Erstmal allgemein ist ein Stoff fest, wenn die intermolekularen Wechselwirkungen stark sind. Nun schau dir dieses Molekül mal an. Du wirst feststellen, dass dieses Molekül sehr viele Hydroxygruppen hat. Und diese bilden Wasserstoffbrückenbindungen zu benachbarten Sorbitolmolekülen aus! Die HBBs gehören mit zu den stärksten intermolekularen Wechselwirkungen. Da du jetzt pro Molekül sechs Hydroxygruppen hast, können sich diese HBBs sehr stark ausbilden. Dadurch ist eine hohe Energie (in Form von Wärme) notwendig, um die Moleküle voneinander zu trennen (= Flüssigwerden des Zuckeralkohols), deshalb ist der Aggregatzustand des Stoffs bei Raumtemperatur fest.
b) Kommen wir zur Synthese. Oben habe ich bereits anklingen lassen, dass Sorbitol die reduzierte Form der Glukose ist. Nochmal kurz ein Exkurs in die Redoxchemie:
Schaue dir mal das C-Atom ganz oben an (also das -CH2OH). Male dir das mal vollständig auf. Also ein C, links und rechts ein H und oben die OH-Gruppe. Du weißt, dass Wasserstoff die Oxidationszahl +I hat, Sauerstoff -II. Diese Gruppe muss insgesamt die Oxidationszahl Null haben. Rechnen wir aber die Oxidationszahlen von H und O zusammen, kommen wir auf +1. Damit muss der Kohlenstoff die Oxidationszahl -I haben. Dasselbe machen wir jetzt bei Glukose. O hat -II, H hat +I. Die Summe ist -I. Damit muss das C-Atom bei der Glukose die Oxidationszahl +I haben.
Du siehst: Die Oxidationszahl des Kohlenstoff-Atoms ist bei Sorbit niedriger. Das heißt, es wurden Elektronen aufgenommen und es fand eine Reduktion statt. Das heißt ja wiederum, dass irgendein anderer Stoff oxidiert werden muss. In der Industrie verwendet man als Reduktionsmittel einfach Wasserstoff und einen Nickelkatalysator. Oder will dein Lehrer auf den Polyol-Weg hinaus?
Aufgabe 4
1-Butanol ud Butan-2-ol sind ja beides Alkohole. Das erste ist ein primärer, das zweite ein sekundärer Alkohol.
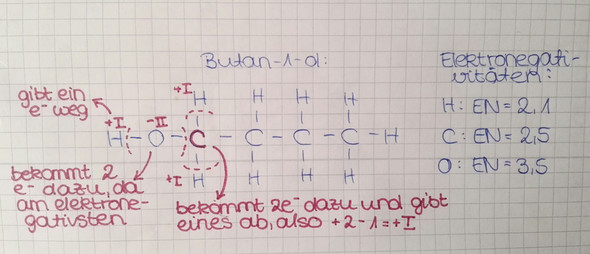
Zunchäst sehen wir uns Butan-1-ol an. Dort sitzt die Hydroxygruppe ja am ersten C-Atom. Wasserstoff hat die OZ +I, Sauerstoff -II. Also ist alles wieder nur rechnen - Das C mit der Hydroxygruppe hat die OZ -I. Andere Möglichkeit: Du machst kenntlich, welche Elektronen welchem Element zugeordnet werden (das elektronegativere Element bekommt die Elektronen!) und dann schaust du. Ich hab dir das hier mal aufgezeichnet:
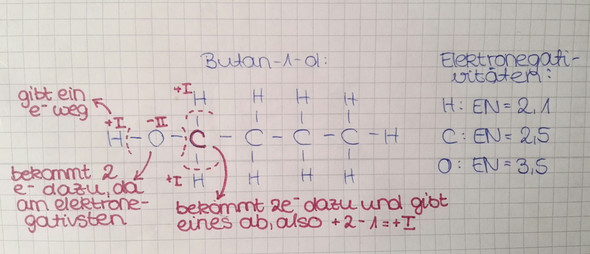
Und das machst du jetzt auch für Butan-2-ol. Übrigens: Die C's links und rechts kannst du sozusagen ignorieren, für deine OZ-Bestimmung ist in diesem Fall nur das H, das C und die Hydroxygruppe wichtig. Wenn du alles richtig gemacht hast, solltest du da auf eine OZ von Null kommen.
Nun zur Teilaufgabe b...
Dort geht es darum, dass Butan-1-ol ein primärer Alkohol, Butan-2-ol ein sekundärer Alkohol ist. Der Trick ist nämlich folgender: Während du primäre Alkohole zu Aldehyden und weiter zu Alkansäuren bis hin zu CO2 oxidieren kannst, geht das bei sekundären Alkoholen nur bis zu den Ketonen. Was du also machen könntest, wäre folgender Versuch:
Fülle in zwei kleine Bechergläser je einen der Alkohole. Erhitze zwei Kupferbleche, bis sie sich mit einer schwarzen Oxidschicht überzogen haben. Nun tauchst du in jedes der Bechergläser eines der Kupferbleche.
Die Beobachtung sollte sein, dass sich beim einen Blech die Oxidschicht relativ schnell auflöst (nämlich beim primären Alkohol!), beim anderen jedoch nur ganz langsam passiert.
Die Redoxgleichung:
R-CH2OH ---> R-CHO + 2e- + 2H(+) (Oxidation)
CuO + 2e(-) + 2H(+) ---> Cu + H2O (Reduktion)
____________________________________________
R-CH2OH + CuO ---> R-CHO + Cu + H2O
Für den sekundären Alkohol kannst du es mal selbst probieren - kleiner Tipp: Es sollte ein Keton entstehen, also etwas nach dem Motto CH3-CO-CH2-CH3.
Eine andere Möglichkeit wäre es, beide Alkohole etwas anzusäuern (bspw mit konz. H2SO4) und anschließend Kaliumpermanganat (KMnO4) hinzuzugeben. Bei Butan-1-ol sollte es sich schnell entfärben, bei Butan-2-ol nur sehr langsam (mit stärkerer Braunfärbung).
Und die Begründung für deine letzte Aufgabe ist richtig! :)
Ich hoffe, ich konnte dir etwas helfen. Falls noch etwas unklar sein sollte, melde dich. :)
LG

Und noch eine Frage: wofür steht in der Reduktions und Oxidationsgleichung das "R"? .

R = Rest. Also der unwichtige Krams, der für die Reaktionsgleichung egal ist :D

Danke für die ausführliche Antwort ^^.
Allerdings frage ich mich, warum bei dem Bild wo du Butan-1-ol gezeichnet hast, bei dem markierten C +I als Oxidationszahl rauskommt, weil eigentlich sind es ja 2 Elektronen von 2 Hs und 1 von dem C danaber, also 5 insgesamt. Und da C nur 4 Elektronen normalerweise hat, müsste es ja eig -I sein.

verschrieben, oh Gott das ist jetzt peinlich! Im Text habe ich aber -I geschrieben! natürlich muss -I rauskommen, da die Summe ja sonst nicht Null ist! Danke, dass du so gut aufgepasst hast!

Hallo GXleif
die Reihenfolge ist richtig. Heptan als Alkan ist nahezu unlöslich in Wasser. Auch Dekan-1-ol ist trotz seiner Alkoholgruppe einem Alkan sehr ähnlich und löst sich daher sehr schlecht in Wasser. Das Ethan-1.2-diol ist dagegen sehr gut löslich bzw. mit Wasser mischbar.
Die Unterscheidung der beiden Alkohole gelingt durch Oxidation mit CuO. Aus dem primären Alkohol wird ein Aldehyd, aus dem sekundären ein Keton.
In diesem Link sind die Gleichungen, allerdings für Propan-1-ol und Propan-2-ol, angegeben. Hier ist auch enthalten, wie allgemein Oxidationszahlen bestimmt werden:
Bei organischen Molekülen kann man die Oxidationszahl leicht bestimmen, wenn man die Strukturformeln zeichnet. Die Elektronen einer Bindung werden ganz dem elektronegativeren Partner zugeteilt. Bei Bindungen zwischen gleichen Atomen werden die Bindungselektronen brüderlich geteilt:
C-H-Bindung: beide Elektronen zum C
C-O-Bindung: beide Elektronen zum O
C=O-Bindung: alle 4 Elektronen zum O
O-H-Bindung; beide Elektronen zum O
C-C-Bindung: jedes C bekommt ein Elektron
Die OZ des C-Atoms berechnet sich dann als Differenz von Valenzelektronenzahl des C (also +4) minus der auf obige Weise ermittelte Elektronenzahl.
Verbrennung von Sorbit:
2 C6H14O6 + 13 O2 ==> 12 CO2 + 14 H2O
LG

In einer Flasche ist 1-Butanol, in der anderen 2-Butanol.
Beides keine IUPAC-Namen, daher läßt sich über Lösungen nur spekulieren.

3) Jede Menge OH-Gruppen und damit Brücken.
4) 1-ol über Alkanal bis Alkansäure oxidierbar 2-ol bloß bis Alkanon, also für selbe Menge bloß halb so viel Ox. mittel.
Letzte ist OK.
Und ich sehe, dass ich nicht aufgepasst hab - es ging um die Verbrennung von Sorbit...entschuldige, mein Fehler!