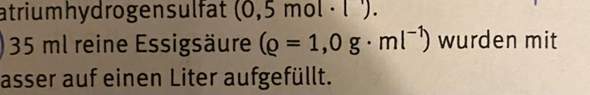Folgende Frage wurde in einer Praktikumsklausur gestellt:
"a.) Skizziere die Titrationskurve einer starken Säure mit einer starken Base (pH-Wert gegen Neutralisationsgrad in %). Markiere den Äquivalenzpunkt, mache dabei deutlich, ob dieser bei einem Ph-Wert kleiner, gleich oder größer 7 lieg und begründe!
b) Was ist ein pH-Indikator. Erläutere kurz seine Funktionsweise!
zu a).
Ein Kommilitone hat folgendes geschrieben und darauf 0 Punkte bekommen:
Ich versteh nicht, warum das falsch sein soll, dem abgesehen davon, daß er pH-Achse und Neutralisationsgrad-Achse vertauscht hat, ist diese Abbildung 1:1 bei uns im Praktikumsskript:
Ich hätte das jetzt, wenn ich das in der Praktikumsklausur gefragt würde, einfach so abgemalt (natürlich nur die Kurve für starke Säure und starke Base) und den Äquivalenzpunkt dann bei pH = 7 und Neutralisationsgrad = 100 gesetzt, weil bei einer 100 %-zentigen Neutralisation einer starken Säure mit einer starken Base, Wasser und neutrales Salz entstehn. Da beide vollständig dissozieren, bleibt die Lösung neutral.
zu b): Hier hat der Kommilitone folgende Defintion geschrieben:
"Gibt an (durch Färbung); ob eine Löäsung oder ein Gemisch, sauer, neutral oder alkalisch ist."
Und das gab einfach eiskalt 0 Punkte!
Ich hab mir jetzt folgende Definition ruasgeschrieben:
"Indikatoren sind schwache organische Säuren (HInd); deren Farbe sich von der konjugierten Base (Ind-) unterscheidet.
HInd + H2O <-> H3O+ + Ind-
Aus dem Massenwirkungsgesetzt folgt pH = pKs + log c(Ind-)/c(Hind). Das Konzentratonsverhältnis von Indikatorsäure (HInd) und konjugierter Base (Ind-) und damit die Frbe es Indikators sind somit vom pH-Wert der Lösung abhängig. Für den Umschlagsbereich eines Indikators, der durch die Änderung des Verhältnisses c(Ind-)/C(HInd), um den Faktor 100 von 1:1o auf 1o:1 charakterisiert ist, gitl pH = pKs ± 1. Wie aus der Titrationskurve einer Titration einer starken Säure (Base) mit einer starken Base (Säure) hervorgeht, erfolgt eine sprunghafte Änderung des pH-Wertes beim Äquivalenzpunkt im Bereich zwischen pH ≈ 4 und pH ≈ 10. Daher sind für die Titrations starker Säuren und Basen alle Indikatoren geeignet, die in diesem pH-Gebiet ihren Umschlagsbereich haben.
Beie iner schwachen Base gilt. Ind (Base) + H* <-> Hind + (Säure)
Ist viel H+ in der Lösung, ist sie sauer und mehr von der Säureform Hind da, so dass Farbe 1 sichtbar ist. Ist weniger H+ in der Lösung ist sie mehr in Baseform (Ind-) und mehr von Farbe 2 da."
Kann ich das so schreiben? Oder ist das zu allgemein und zu wenig auf die Funktionsweise bezogen? Ich bin mir nicht sicher, weil die Antworten meines Kommilitonen ja direkt 0 Punkte gebracht haben und ich daher nichts falsch machen will.
LG,
Hans Sarpei