Wieso hat Schwefeldioxid drei freie Elektronenpaare und nicht vier? Wenn ich das Molekül zeichne, hat es jeweils eine Dopplelbindung mit dem Sauerstoffatom?!?
Bin für jede Hilfestellung bezüglich der Aufgabenbearbeitung dankbar! danke!!
2 Antworten

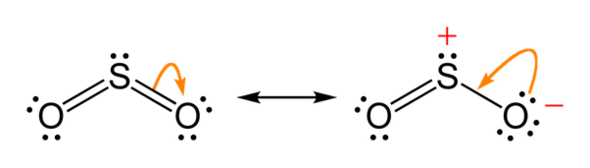
Wenn ich dein Problem richtig verstehe, ist es so, dass SO2 auch mesomere Grenzstrukturen besitzt, die für das Schwefel-Atom energetisch günstiger sind. Dabei sind die beiden Sauerstoff-Atome nicht doppelt an Schwefel gebunden, sondern jeweils eins der beiden doppelt und eines nur einfach, so dass es 6 freie Elektronen um sich herum hat und somit negativ geladen ist. Das Schwefel wäre dabei positiv geladen, daher sind die Strukturen energetisch gleichwertig. Für das Schwefel sind die beiden Grenzstrukturen günstiger, da dabei die Oktettregel erfüllt wäre. Mit einem einfach gebundenen Sauerstoff hätte es nämlich mit seinem freien Elektronenpaar genau 8 Elektronen um sich herum, aber die Oxidationszahl wäre in diesem Fall +I, da ihm aufgrund der Elektronegativität nur 5 Elektronen zugesprochen werden. Das Sauerstoffatom, das einfach gebunden ist, wäre somit negativ geladen, da ihm 7 Elektronen zugesprochen werden. Bei deiner Version hätte Schwefel mehr als 8 Elektronen um sich herum, da es zweimal doppelt gebunden ist, also 10 Elektronen mit seinem freien Elektronenpaar.
Trotzdem hätte das gesamte Molekül einmal 5 freie Elektronenpaare und einmal 6.

"aber die Oxidationszahl wäre in diesem Fall +I"
Was du meinst, nennt sich "formale Ladung". Die OZ des Schwefel im Dioxid ist immer +4, egal wie du die Bindungen zeichnest.

Schwefel hat 6 Valenzelektronen. Davon werden 4 für die Bindungen mit den Sauerstoffatomen (ebenfalls je 6 Valenzelektronen) gebunden, bleiben 2 übrig, das ist 1 freies Elektronenpaar.
Jedes Sauerstoffatom hat noch 2 freie Elektronenpaare.
Macht zusammen 5 freie Elektronenpaare in SO2.
