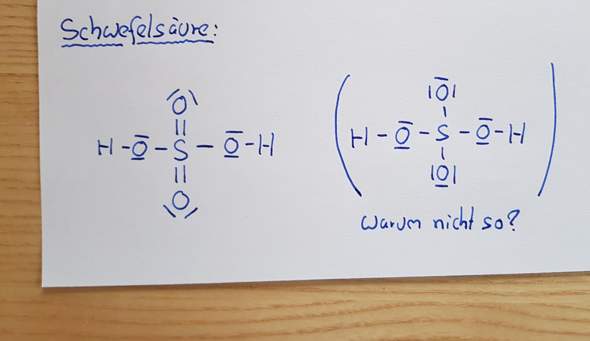
Warum sieht die Strukturformel von Schwefelsäure so aus?
Ich habe mal eine Frage & zwar, warum ist die Strukturformel von Schwefelsäure so wie links abgebildet? Die rechte Version würde doch auch funktionieren & alle Stoffe hätten Ihre "Edelgaskonfiguration"
2 Antworten

Moin,
also zunächst einmal sind das keine Lewisformeln der Salz-, sondern der Schwefelsäure (wie es ja auch korrekt auf deinem Zettel steht)...
Aber um deine Frage zu beantworten: Es wird heutzutage sogar angenommen, dass deine rechts stehende Formel sehr viel wahrscheinlicher den realen Verhältnissen entspricht als die links stehende Formel.
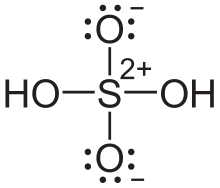
Allerdings musst du noch an die beiden Sauerstoffatome oben und unten eine formale Minusladung schreiben, während an das Schwefelatom in der Mitte die Formalladung 2+ gehört. Etwa so:
LG von der Waterkant
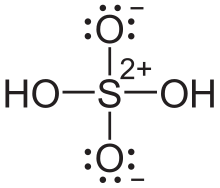

Ja. Formal gehören zum Schwefelatom im Schwefelsäuremolekül nur noch vier Elektronen im Vergleich zum atomaren Zustand, wo es sechs Valenzelektronen hat. Das ist dann so, als hätte es zwei Elektronen abgegeben, so dass sich eine Formalladung von 2+ ergibt. Da dies aber nur formal so ist, bezeichnet man diese Ladung folglich als „Formalladung”. Dem Schwefelatom ist das nämlich völlig „egal”, weil es wichtiger ist, durch die Atombindungen auf acht Elektronen zu kommen und damit eine Edelgaskonfiguration zu kommen.
Analoges gilt dann auch für die einzelnen Sauerstoffatome. Sie haben im Molekül formal nun sieben Elektronen (anstelle von sechs Valenzelektronen im atomaren Zustand). Das heißt, dass hier formal ein Elektron mehr vorhanden ist. Somit ergibt sich eine Formalladung von 1–.
Manchmal werden die Formalladungen deshalb auch eingekreist, um sie von echten Ladungen von Ionen zu unterscheiden.
Nochmals ein lieber Gruß von der Waterkant

Danke euch für eure Bemühungen, klang alles ganz gut so weit & hatte es auch verstanden. Wurde dennoch heute von meiner Lehrerin angeschrien, dass die rechte Formel anscheinend ja komplett falsch ist & dass ich garnichts checke. Zum Glück ist meine Präsentation erst morgen & ich hab nochmal nachgefragt. Muss dann wohl doch Die Linke verwenden...

Tja, das tut mir leid für dich, dass du eine uniformierte und ignorante Lehrerin hast, die nicht bereit ist, sich auf dem Laufenden zu halten. Solch dämliche Menschen gibt es eben überall...
Ach ja, frag sie doch am Ende deines Vortrags mal, wie sie mit der linken Darstellung die Befunde erklärt, dass ein Schwefelsäuremolekül eine tetraedrische Geometrie mit annähernd gleich langen O-S-Bindungen hat, die auch noch energetisch etwa gleichwertig sind?! Die O=S-Bindungen wären nämlich kürzer als die HO-S-Bindungen, weil es Doppelbindungen sind. Außerdem wären die Bindungsenergien verschieden, was sie jedoch nach neuesten Erkenntnissen nicht sind. Und tetraedrisch wäre die Hyperkonjugation der linken Darstellung auch nicht. Zu allem Überfluss hast du ja auch noch einen anderen Finger selbst in die Wunde gelegt: In der linken Darstellung erfüllt das Schwefelatom NICHT die Edelgasregel. Für diese Erklärung muss man also die energetisch deutlich schlechter liegenden d-Orbitale bemühen und die besagte Hyperkonjugation konstruieren. All diese Widersprüche lösen sich sofort in Luft auf, wenn man die rechte Darstellung (mit Formalladungen) benutzt. Damit wären alle Befunde und das Problem mit der Edelgasregel (Oktettregel) sofort im Einklang.
Wie gesagt, dämliche Menschen gibt es überall...
Viel Glück bei deinem Vortrag.
LG von der Waterkant

Eines vorweg: Schwefelsäure
Zu deiner Frage: Die Theorie der Hypervalenz gilt inzwischen als veraltet. Damit ist die rechte Schreibweise die aktuell richtige; die linke Schreibweise mit dem sechsbindigen Schwefelatom ist veraltet.
Nichtsdestotrotz hast du bei der rechten Schreibweise die Ladungen vergessen:
- Das zentrale Schwefelatom bekommt +2
- Die zwei Sauerstoffatome oben und unten bekommen -1
VG

Vielen Dank für die schnelle Antwort!👍 Ja habe mich in der Frage ausversehen verschrieben, ist korrigiert. Das mit den Ladunhen verstehe ich nicht so ganz.
Warum besitzt der Sauerstoff eine einfach negative Ladung? Da er anstatt 6 Außenelektronen 7 wirklich an sich "dran kleben" hat?
Und warum besitzt das Schwefelatom eine 2fach positive Ladung? Hier wäre meine Theorie, da er nur noch 4 Elektronen wirklich nah bei sich hat, anstatt im Normalzustand 6.
Die anderen 4 sind ja eher beim Sauerstoff.
Stimmt diese Theorie?


Danke euch für eure Bemühungen, klang alles ganz gut so weit & hatte es auch verstanden. Wurde dennoch heute von meiner Lehrerin angeschrien, dass die rechte Formel anscheinend ja komplett falsch ist & dass ich garnichts checke. Zum Glück ist meine Präsentation erst morgen & ich hab nochmal nachgefragt. Muss dann wohl doch Die Linke verwenden...

Ui, Kollegen, die Inkompetenz durch Lautstärke aufwiegen wollen. Das ist bitter. Mein Beileid!
Das "neue" Modell ist gegen Ende meines Studiums aufgekommen. Da war ich noch HiWi an der Uni. Das muss 2007 etwa gewesen sein.

Schade, dass neue Erkenntnisse immer so lange brauchen bis sie in den Schulbüchern landen. Hier ist es schon angekommen:
https://www.chemieunterricht.de/dc2/schwefel/s-so4-mol.htm
Du kannst Deiner Lehrerin zum Abschied (nicht vorher - diese Art Lehrerin ist extrem rachsüchtig) ja diesen Artikel ausdrucken (wahlweise das kostenlose Abstract oder den ganzen Artikel):
Vielen Dank für die schnelle Antwort!👍 Ja habe mich in der Frage ausversehen verschrieben, ist korrigiert. Das mit den Ladunhen verstehe ich nicht so ganz.
Warum besitzt der Sauerstoff eine einfach negative Ladung? Da er anstatt 6 Außenelektronen 7 wirklich an sich "dran kleben" hat?
Und warum besitzt das Schwefelatom eine 2fach positive Ladung? Hier wäre meine Theorie, da er nur noch 4 Elektronen wirklich nah bei sich hat, anstatt im Normalzustand 6.
Die anderen 4 sind ja eher beim Sauerstoff.
Stimmt diese Theorie?