Warum hat eine Druckveränderung keinen Einfluss auf die Ausbeute (Chemie)?
Die Gase Chlor und Wasserstoff reagieren miteinander zu gasförmigem Chlorwasserstoff.
H2 + Cl2
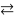
Begründe, dass der Druck keinen Einfluss auf die Ausbeute hat.
Wäre euch sehr dankbar, wenn ihr mir das erklären könntet!
2 Antworten

Aus einem mol Wasserstoff und einem mol Chlor werden 2 mol Chlorwasserstoff(gas). Auf der Eduktseite stehen also insgesamt 2 mol an Gasen und rechts auch. Die Gase nehmen pro mol in etwa dasselbe Volumen ein (siehe molares Volumen). Deshalb kommt es bei der Reaktion zu keinen Volumenänderungen und in der Konsequenz auch zu keinen Druckänderungen. Ein von außen aufgebrachter Druck erzeugt also keine Bevorzugung der Reaktionsrichtung bzw. der Gleichgewichtseinstellung (siehe auch Prinzip von Le Chatelier) https://de.wikipedia.org/wiki/Prinzip_vom_kleinsten_Zwang

Alle Gase sind gleich groß - es ist also egal welches Gas vorliegt. Daher ändert sich bei der Reaktion kein Volumen --> daher hat der Druck keinen Einfluss auf das Gleichgewicht.