Wann ist ein Element bzw. Isotop stabil oder instabil?
Hallo,
brauche unbedingt Hilfe..
Wann ist ein Element bzw. Isotop stabil/instabil? Ich habe gelesen dass Sauerstoff ein stabiles Mischelement ist. In einer anderen Quelle steht dass O-16 und O-18 stabil sind. Das würde heißen, dass O-15 nicht stabil ist? Warum zählt man dann Sauerstoff zu den stabilen Mischelementen, wenn es auch instabile Sauerstoffisotope gibt?!
7 Antworten

Hier geht es um den Atomkern, die Elektronen spielen dabei keine Rolle.
Ein Element ist durch die Anzahl der Protonen im Kern bestimmt. Die Anzahl der Protonen findet man im Periodensystem als Ordnungszahl wieder.
Die stabilste Konfiguration liegt bei den leichten Elementen bis etwa Magnesium dann vor, wenn sich im Kern genausoviele Neutronen befinden wie Protonen. Je schwerer die Elemente sind, umso mehr verschiebt sich das Verhältnis der stabilsten Konfiguration in Richtung Neutronen. Z.B. bei Blei mit 82 Protonen liegt der stabilste Kern vor, wenn 124, 125 oder 126 Neutronen dazu kommen.
Die stabilste Konfiguration ist dadurch gekennzeichnet, dass sie am wenigsten Energie gegenüber den Isotopne enthält. Und da in der Natur alles (außer wenn es lebt, da ist es umgekehrt) zum geringsten Energieniveau strebt, liegt hier der stabile Zustand vor.
Als Faustformel kann man nun ansetzen, dass je mehr die Anzahl der Neutronen vom stabilen Zustand nach oben oder unten abweicht, umso mehr Energie enthält der Kern, umso stärker ist das Bestreben, diese Energie abzugeben (in Form von energiereicher Strahlung), umso leichter zerfällt der Kern und umso kürzer ist die Halbwertszeit. Je leichter ein Element ist, umso besser stimmt diese Faustformel. Die schweren Elemente machen da bisweilen Ausnahmen.

Sauerstoff ist eine Mischung aus drei stabilen Isotopen: ¹⁶O (99.8%), ¹⁷O (0.04%) und ¹⁸O (0.2%). In der Natur gibt es auch ganz kleine Mengen des instabilen ¹⁵O (Halbwertszeit τ=2 min), die sich in der Atmosphäre durch γ-Strahlen bilden.
Ob ein Isotop stabil ist oder nicht, läßt sich ganz leicht angeben: Es gibt ja drei radioaktive Zerfallsmode (α, β⁺, β⁻), die zu drei verschiedenen Zerfallsprodukten führen. Wenn wenigstens einer davon Energie freisetzt, dann ist der Kern instabil; nur wenn alle drei Energie kosten, ist der Kern stabil.
Wenn ein Kern instabil ist, dann muß er zerfallen, aber er kann das immer noch sehr langsam tun. So ist z.B. Kalium ein radioaktives Element, denn 0.1% des natürlichen Kaliums besteht aus dem Radio-Isotop ⁴⁰K, das mit einer Halbwertszeit von gut einer Milliarde Jahren langsam zerfällt und dabei vornehmlich ⁴⁰Ar liefert.
Das Metall Bismut hat nur radioaktive Isotope. Natürliches ²⁰⁹Bi hat aber eine Halbwertszeit von 2·10¹⁹ Jahren, und das ist viiiiel länger als das Universum alt ist. Daher bezeichnet man solche Isotope auch als „praktisch stabil“.

Ein Element heißt stabil, wenn es mindestens ein stabiles Isotop hat. Es müssen nicht alle Isotope des Elements stabil sein - das geht gar nicht, denn jedes Element hat instabile Isotope.

Voraussagen lässt sich das kaum, es ist einfach beobachtbar, feststellbar, welche Isotope eines Elements stabil sind und welche nicht.
Es muss ein "ausgewogenes" Verhältnis zwischen Protonen und Neutronen bestehen, damit des stabil ist. Wenn es zuviel vom einen oder andern hat, ist es instabil, radioaktiv, und wird eben unter Abgabe von (Teilchen-)Strahlung in ein stabiles Element "zerfallen". Ev. über mehrere Stufen (Zerfallsreihe).
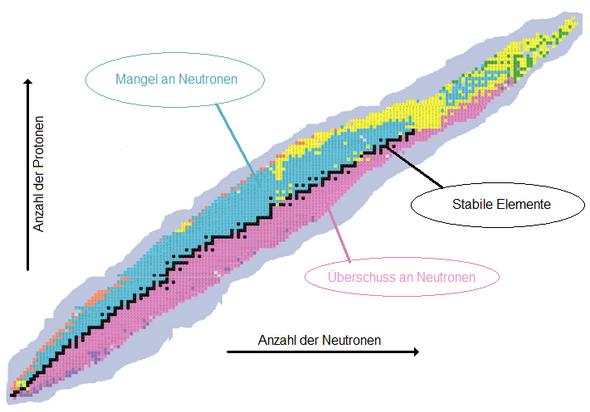
Das folgende Bild ("Banane" genannt, oder Nuklidkarte oder Zerfallsreihe) findet man überall im Netz (hier von Wikipedia), es zeigt die wenigen stabilen Kombinationen (schwarz) und die vielen möglichen instabilen.
Ab einer gewissen Ordnungszahl gibt es nur noch instabile Elemente, offenbar weil sich der Kern ob dem "Gedränge" nicht mehr zusammenhalten kann.
Bis heute rätselt man, ob es irgendwo ganz weit draussen noch unentdeckte Elemente in "Inseln der Stabilität" geben könnte.
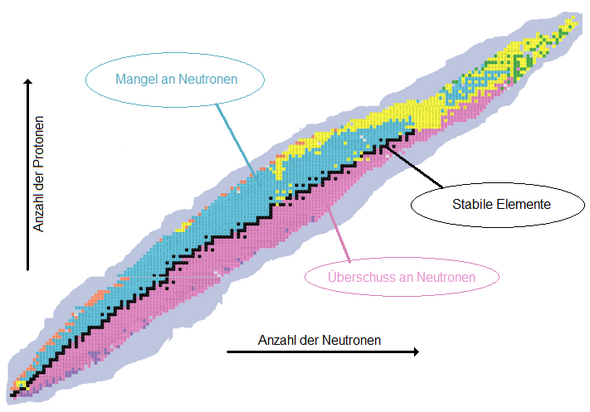
Nuklidkarte mit radioaktiven Zerfallsarten:
schwarz = stabil
rosa = β−-Zerfall wegen Neutronenüberschuss
blau = EC- oder β+-Zerfall wegen Protonenüberschuss
gelb = α-Zerfall

In einigen Punkten muss man da sauberer unterscheiden.
Zunächst mal gilt stabil/instabil nur für einzelne Isotope, nicht für Elemente.
Dann must du zwischen natürlichem Vorkommen und künstlich hergestelltem unterscheiden.
Von jedem Element wurden inzwischen künstlich instabile Isotope hergestellt, die teils nur Sekundenbruchteile existieren.
Also ist Sauerstoff kein "stabiles Mischelement", sondern ein Element, das natürlicherweise aus mehreren stabilen Isotopen besteht. Zu den stabilen Isotopen zählt übrigens auch O-17.
Kohlenstoff besteht natürlicherweie auch aus mehreren Isotopen, C-12, C-13 und C-14, von denen C-14 instabil ist. C-14 existiert deswegen, weil es ständig gebildet wird, durch die kosmische Strahlung aus dem Luftstickstoff. Wäre Kohlenstoff nach der zitierten Logik dann ein "instabiles Mischelement"? Finde ich etwas schräg, weil die meistenC-Atome ja stabil sind.