Unterschied schweflige Säure und Schwefelsäure?
Worin unterscheidet sich die schweflige Säure von der Schwefelsäure?
5 Antworten

Moin,
die Schweflige Säure ist eine unbeständige, nur in wässriger Lösung existierende zweiprotonige Säure mit einer Säurestärke von pKs1 = 1,81 und pKs2 = 6,99 und hat die Summenformel H2SO3. Aber wie gesagt, diese Substanz lässt sich nicht isolieren, weil sie sowohl beim Kochen als auch bei Kristallisieren zerfällt.
Ihre Salze (in Form von Sulfiten) sind dagegen beständig; die Hydrogensulfite sind dagegen erneut nur in wässriger Lösung existent und nicht isolierbar.
Die Schwefelsäure ist eine beständige und isolierbare zweiprotonige Säure mit einer Säurestärke von pKs1 = –3 und pKs2 = 1,9, womit sie wesentlich stärker sauer als Schweflige Säure ist. Sie hat die Summenformel H2SO4, was bedeutet, dass sie gegenüber der Schwefligen Säure am Schwefelatom ein Sauerstoffatom mehr angelagert hat.
Ihre Salze (Sulfate & Hydrogensulfate) sind stabil und isolierbar.
LG von der Waterkant

Schwefelsäure: H2SO4
Schwelfige Säure: H2SO3 (ein Sauerstoffatom weniger)

Andere Oxidationsstufe des Schwefels.

Hier steht ein Unterschied.


Ecosia: Schwefelsäure und schweflige Säure
Ecosia/Bilder: Schwefelsäure und schweflige Säure
Ecosia/Videos: Schwefelsäure und schweflige Säure

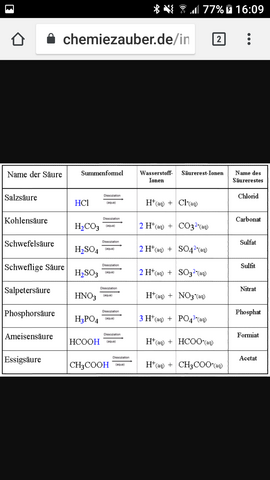

Im Großen und Ganzen sehr verschiedene Säuren, denn:
Schwefelsäure = H2SO4
schweflige Säure = H2SO3
Sprich: Die schweflige Säure hat ein Sauerstoffatom weniger als die Schwefelsäure!
Ist damit deine Frage beantwortet? :)
LG