pH-Wert und Konzentrationsberechnung - Abitur?
Guten Tag an diesem sonnigen Tage🌞
Bald steht das Abitur an und ich gehe meine Klausuren durch, wobei mir doch noch einige Fragen aufgekommen sind:
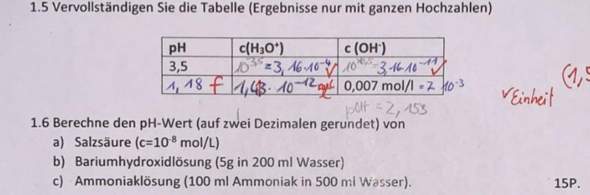
Das hatte ich diesbezüglich:

Zum einen verstehe ich nicht wie man auf die unteren Werte der Tabelle kommt, das hatte ich ja falsch. Bei der a ist mir nicht klar,wieso ich das hinzugerechnet hatte xD, zumal es doch normalerweise einfach -log{c(H3O+)} wäre...
Bei der b) s. Fehler....
Ich würde mir sehr freuen, wenn mir jmd helfen würde..
Lg und bleibt gesund, Danke
2 Antworten

> wie man auf die unteren Werte der Tabelle kommt,
Indem man die Definition des pH-Wertes erinnert, und dann, notfalls durch stumpfes Eintippen in den Taschenrechner, von "1,4 * 10^(-12)" den Logarithmus ermittelt.
> Bei der a ist mir nicht klar,wieso ich das hinzugerechnet hatte xD,
Weil Du einen lichten Moment hattest?
Wenn Du eine winzige Menge Säure hast, ergibt sich eine winzige Menge von H3O+, die aus der Säure stammen. Plus eine vergleichbar große Menge von H3O+, die aus der Eigendissoziation des Wassers stammen. Das ist immer so, nur kann man das bei grßerer Säurekonzentration vernachlässigen.
Zur b): Lies' doch einfach, was der Lehrer angemerkt hat: 1 mol Ba(OH)2 liefert zwei Mol OH-


Kommt auf den Zusammenhang an. In Deinem Beispiel geht es um 10^(-7) mol/l, die bereits vorhanden sind. Je nach Genauigkeitsanspruch werden zusätzlich zugegebene Konzentrationen von 10^(-8) oder auch erst 10^(-9) und kleiner als vernachlässigbar klein ignoriert.
Wenn Du dagegen im Hochvakuum 10^(-9) mol/l hast, sind zusätzliche 10^(-9) eine Verdoppelung und damit keinesfalls vernachlässigbar.

Bei 1.5: 0,007 mol OH- sind recht basisch. Rechne c(H+)*c(Oh-)=10^-14 (Löslichkeitsprodukt bei 20°)

Danke! Also ist c(H3O+)= 1.43 * 10^-12 mol/l und pH=1?
Lg

Mit 1,43^10^-12 hast du schon recht, allerdings ist der pH-Wert über den negativen 10er-Logarithmus definiert, d. h. du musst die Basis nach 10 umstellen. Ich komme auf etwa 10^-11,84, d. h. der pH läge bei ~11,84

Danke, was meinen Sie mit nach 10 umstellen.

Steckt doch im Namen drin - dekadischer Logarithmus bezieht sich auf 10^x. 1000^1 kann man bspw. nach 10^3 umstellen.

Ja,danke...jedoch verstehe ich das nicht ganz auf das Beispiel bezogen, bei Ihnen kommt ja ein ganz anferer Wert raus..

1 mol OH- pro L ist pH=14 oder pOH=0, 0,1 mol OH- pH=13 usw., verstehst du? PS:musst mich nicht siezen, bin erst 13. LG Jona.

Danke, wow, 13 :O woher weisst du denn schon sowas? Respekt!:)
Ehrlich gesagt dachte ich an c(OH-) * c(H3O+)=10^-14 und nach c(H3O+) ungestellt kommt eben das raus...könntest du evtl. deine Rechnung aufschreiben.
Lg

0,007 mol/L OH- ist gerundet 0,01 oder 10^-2. Das ist ein pH-Wert von 12, weil pH+pOH=14

Stimmt, jedoch darf ich doch nicht einfach runden, oder :/


Evtl. komische Frage,doch ab wann gilt denn eine Konzentration als sehr klein
Lg