pH-Wert Berechnung/Titration?
Kann mir bitte jemand bei folgendem Beispiel weiterhelfen.
50ml einer Ammoniaklösung mit einer Konzentration von 0,1mol/L (KB=1,810^-5) werden mit HCL einer Konzentration von 0,1mol/L titriert. Berechnen sie den pH-Wert.
a) der Ausgangslösung
b) nach Zugabe von 10ml HCL.
Vielen Dank 😊
2 Antworten

Die Ausgangslösung ist einfach eine schwache Base in Wasser mit pH=11.12. Diese Zahl kriegt man aus dem Massenwirkungsgesetz für reine Base: x=c(NH₄⁺)=c(OH⁻) und K=x²/(c₀-x) mit c₀=0.1 mol/l.
Nach 10 ml Verbrauch hast Du folgende Situation: Gesamtvolumen 60 ml, darin tummeln sich 5 mmol NH₃ und 1 mmol HCl. Die neutralisieren zu 4 mmol NH₃ und 1 mmol NH₄⁺, also hast Du einen ziemlich unsymmetrischen Puffer und kannst Dein Glück mit der Henderson–Hasselbalch-Gleichung versuchen. Der pH ist 9.86.
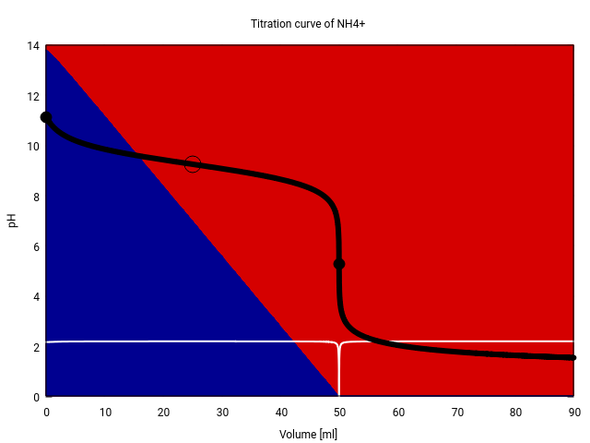
Als Bonus gibt es hier noch einmal die ganze Titrationskurve. Die Hintergrundfarben zeigen, wie viel NH₃ (Blau) und NH₄⁺ (rot) in der Lösung vorhanden sind.
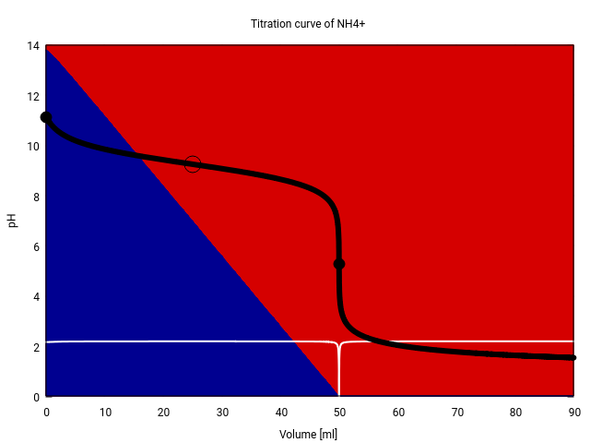


Nach Zugabe von HCL bin ich auch überfragt aber :
Für die 50 mL Ammoniaklösung, wäre es doch :
pH = pKb * (-lg (c (NH3)))
(pKb = -lg Kb)

* dann wäre es der pOH wert, weil is ja keine Base musst dann noch umrechnen

Für HCL bin ich doch noch dahintergekommen glaub ich.
m/M*z = V*c*z => m= V*c*z*M/z
m = 10 mL * 0,1 mol/mL * 1 * 17,031 g/mol / 1
= 17,031 mg
c = n/V 0= 1/60mL = 0,016.
und dann das gleiche wie oben anwenden.
glaube ich :D