Masse/Stoffmenge berechnen aus Volumen, Säurekonzentration, pkS & pH(Puffer)?
Ich hab gegeben: 100 mL Essigsäure mit c=0,1mol/L und pKs=4,75 & Puffer-pH=5
Wie viel Kaliumhydroxid muss man in der Essigsäure lösen, um den Puffer-pH-Wert von 5 zu kriegen. Volumenveränderungen sind vernachlässigbar.
Die Formel ist ja pH=pKs+Log(nBase/nSäure)
<=> nBase = 10^(pH-pKs)*nSäure
Was muss ich für die Säure einsetzen, denn es geht ja bei nSäure um die Stoffmenge, die noch übrig ist. Das weiß ich doch ohne die Stoffmenge von KOH nicht, oder?
1 Antwort

Dein Ansatz ist richtig: Du verwendest die Henderson–Hasselbalch-Gleichung. Da Du auf einen bestimmten pH kommen willst, mußt Du nach dem Quotienten der Konzentrationen von CH₃COOH und CH₃CO₂¯ auflösen:
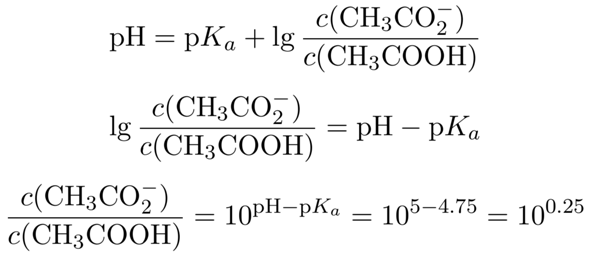
Wir kennen jetzt also das nötige Konzentrationsverhältnis zwischen Acetat und Essigsäure im Puffer; es beträgt 10⁰·²⁵≈1.78. Außerdem entsteht das Acetat ja durch Reaktion der Essigsäure mit dem NaOH, wir wissen also, daß die Summe aus Acetat und Essigsäure im Puffer immer der Ausgangskonzentration c₀=0.1 mol/l entsprechen muß. Daher setzen wir c(CH₃CO₂¯)=c₀−c(CH₃COOH) ein und lösen nach der Acetatkonzentration auf:
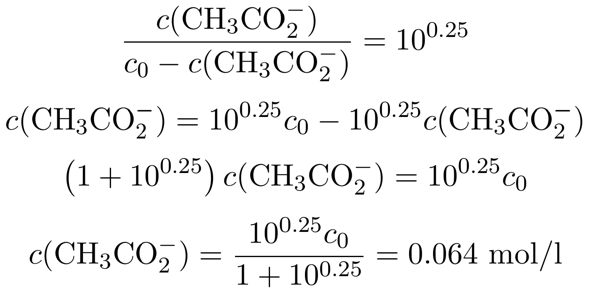
Wir sehen also, daß wir in der Lösung 0.064 mol/l Acetat brauchen, um auf pH=5 zu kommen; daher müssen wir pro Liter Lösung 0.064 mol NaOH zugeben, bzw. pro 100 ml 0.0064 mol, das sind 256 mg NaOH pro 100 ml.
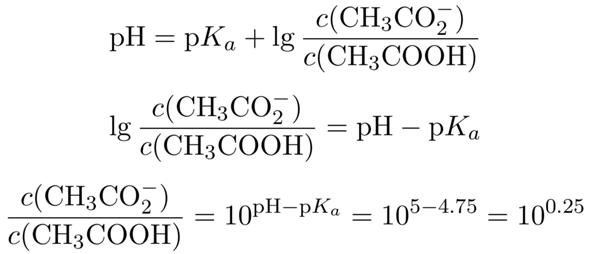
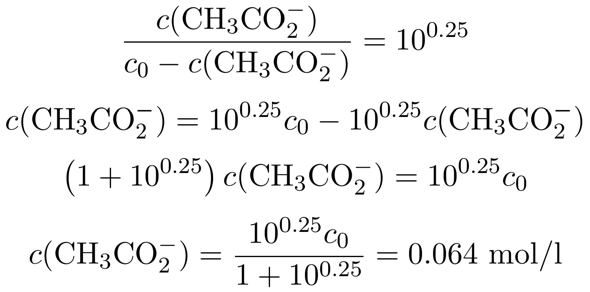

Danke, ich glaub ich muss mir das noch ein paar Mal anschauen, ums zu verstehen, aber das geht ja viel einfacher, wenn man das richtige Ergebnis und den passenden Lösungsweg kennt.