Massenanteil und Stoffmengenkonzentration von Phosphorsäure ausrechnen!?
Moin,
In diesem Versuch wird Phosphorsäure "bestimmt". Wir titrieren Natronlauge als Maßlösung c(NAOH) = 0,2 mol/L mit Phosphorsäure , c(H3PO4) = 85%
Wir haben es so gemacht , dass wir 15ml von der Phosphorsäure in ein Becherglas gegeben haben. Dann haben wir mit NAOH lostitriert und in 1ml Schritten den pH-Wert gemessen.
Jetzt habe ich eine Messreihe mit Verbrauch in Volumen - gemessener pH Wert. Einen Äquivalenzpunkt kann ich jetzt nicht wirklich feststellen , da der pH Wert immer angestiegen ist , aber nicht wirklich EXTREM von einem Punkt zu einem anderen....
Fragen:
-
Muss ich den Äquivalenzpunkt und die Messwerte bei der Bestimmung des Massenanteils und der Stoffmengenkonzentration berücksichtigen?
-
Wie bestimmt man den Massenanteil ?
-
Wie bestimmt man die Stoffmengenkonzentration?
Bitte nicht einfach nur eine Formel hinklatschen und das wars...Bitte Schritt für Schritt erklären , damit ich das nachvollziehe. :)
2 Antworten

''c(H3PO4) = 85%'' finde den Fehler...
Wieso titrierst du überhaupt, wenn du bereits eine Gehaltsangabe für die Phosphorsäure hast?
Der pH-Wert soll auch immer steigen, die Frage die man sich stellt ist, wo steigt der pH-Wert am meisten.
Wenn du das Mathematisch herausfinden willst musst den den pH Wert gegen V(NaOH) auftragen und eine Funktion (Polynom 4. Grades müsse es sein aber nicht ganz sicher) anpassen. Von dieser Funktion suchst du dann die Wendepunke (f''(x)=0). Es gilt Wendepunkt=Äquivalenzpunkt.
Am 1. Äquivalenzpunkt:
c(H3PO4)*V(H3PO4)=c(NaOH)*V(NaOH)=n(H3PO4)=n(NaOH)
Stoffmengenkonzentration:
c=n/V
Massenanteil:
Du musst herausfinden wie schwer deine 15mL Phosphorsäurelösung waren, dazu nimmt man eine Dichtetabelle.
Dichte*Volumen=Masse=m(ges)
m(H3PO4)=n(H3PO4)*M(H3PO4)=m(H3PO4)
w(H3PO4)=m(H3PO4)/m(ges)


Ok. Also kommt es von dem 15ml. Volumen.
Also brauchen wir den Äquivalenzpunkt NICHT für die Massenanteil und Stoffmengenkonzentration Berechnung.
Wofür dann? Man soll ihn einfach nur angeben. Ob rechnerisch oder zeichnerisch. Habe ich das richtig verstanden?


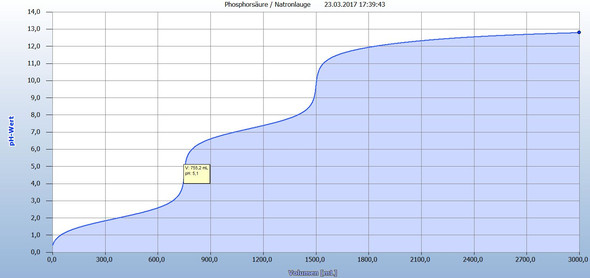
Ich habe Dir eine Titration mit den von Dir vorgegebenen Daten simuliert (s. Bild). Du erhältst eine Titrationskurve, die zwei Äquivalenzpunkte aufweist. Der dritte Äquivalenzpunkt ist aufgrund der Verdünnung nicht zu erreichen.
Bei pH = 5,1 und einem Verbrauch an Natronlauge von V(Natronlauge) = 755,2 mL ist der erste Äquivalenzpunkt erreicht.
Kannst Du jetzt die von Dir gewünschten Daten berechnen?

Also muss der Äquivalenzpunkt berücksichtigt werden?
Nein...Ich kann es ehrlich gesagt nicht ausrechnen , da mir einige Grundlagen zum chemischen Rechnen fehlen , deshalb habe ich darum gebittet, mir das mal eben Schritt für Schritt zu erklären.
Also...Nehmen wir mal an der Äquivalenzpunkt wird bei einem Verbrauch von 755,2mL (Sicher , dass du dich nicht vertipp hast?) bei pH 5,1 erreicht...Wie gehe ich jetzt bei der Berechnung vom Massenanteil und Stoffmengenkonzentration vor?
Ich werde dann später meine Messwerte selber im Diagramm eintragen und den Äquivalenzpunkt mit meinen Werten ermitteln

Mein Kommentar zu dem großen Verbrauch an Natronlauge bis zum 1. Äquivalenzpunkt:
Bedenke, dass Du die gegebene Phosphorsäure, die eine Konzentration von c(Phosphorsäure) = 15 mol/L hat, mit einer dazu sehr verdünnten Natronlauge titriert wird.
Die Simulation entspricht aber nicht einer tatsächlichen Titration.
Für die Auswertung betrachte die Antwort von labmanKIT.
Hast recht. Das ist natürlich blödsinn , wenn ich die Konzentration schon habe.
Das mit dem Massenanteil ist verständlich erklärt.Ich werde es nicht mathematisch berechnen sondern werde mich an meinen titrierten werten orientieren und den äquivalenzpunkt anhand der plötzichen steigung auswählen...sollte auch in ordnung gehen?
jetzt wo es etwas unklar ist bei der stoffmengenkonzentration.
Soll ich als V den Verbrauch nehmen , wo mein ph bei der titration angesprungen ist? sprich den äquivalenzpunkt?