Ist eine K(HSO4) Lösung sauer?
Das Ergebnis basiert auf 3 Abstimmungen
2 Antworten
Von
Experten
DieChemikerin
und
Spikeman197
bestätigt

Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Base, Formel, Reaktion
ja
Ja, KHSO₄ oder NaHSO₄ sind saure Salze, weil das HSO₄¯-Ion noch ein H⁺ abgeben kann und das auch sehr gerne tut. Wäßrige KHSO₄-Lösungen sind deshalb ziemlich sauer, sogar noch ein Stück saurer als Essigsäure oder Phosphorsäure.
Hier siehst Du es genauer:
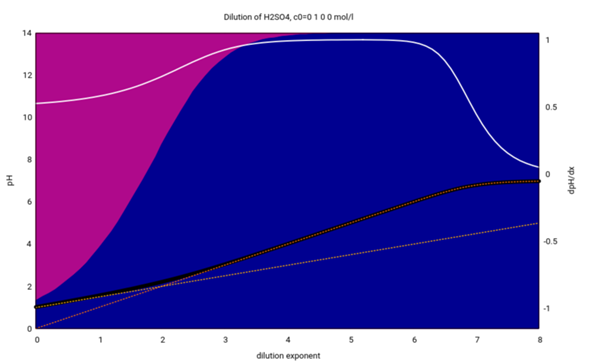
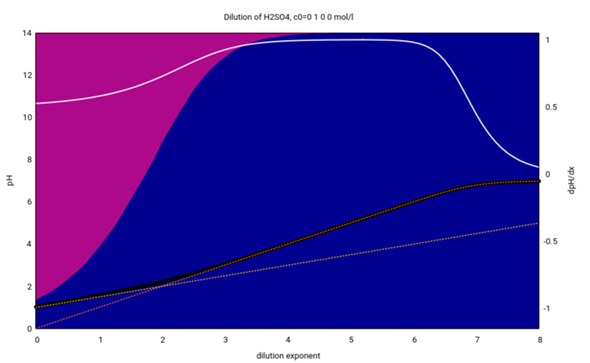
- Die x-Achse gibt die Konzentration logarithmisch an (c=10¯ˣ)
- Die schwarze Kurve zeigt den pH-Wert einer entsprechenden KHSO₄-Lösung
- Die weiße Kurve ist die erste Ableitung davon; aus theoretischen Gründen erwartet man einen Wert von ½ für schwache und 1 für starke Säuren
- In der Lösung findet man bei hohen Konzentrationen x<1 → c>0.1 mol/l vorwiegend HSO₄¯-Ionen (violette Hintergrundfarbe), aber bei kleineren Konzentrationen x>3 → c<0.001 mol/l fast nur noch Sulfationen (blauer Hintergrund), dalso ist das Hydrogensulfat dann völlig deprotoniert.
- Die gelbe punktierte Kurve zeigt den pH-Wert, den man mit der Formel für schwache Säuren herausbekommt; sie stimmt notdürftig für konzentrierte Lösungen (x=0 → c=1 mol/l), weicht aber bei höherer Verdünnung dramatisch vom richtigen Wert ab.
- Dagegen bekommt man mit der Formel für starke Säuren (die orange punktierte Kurve) gute Resultate für x>2 → c<0.01 mol/l.
Also ja, KHSO₄ benimmt sich in Wasser wie eine mittelstarke Säure. Das gewöhnliche Kaliumsulfat, K₂SO₄, ist dagegen fast neutral und nur ganz schwach basisch, mit pH-Werten von 7 bis 8 je nach Konzentration — es hat ja kein H⁺ mehr, das es abgeben könnte.

Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Formel, Reaktion, Säure
ja
Sogar ziemlich!
Auch die 2. Stufe der Schwefelsäure ist noch eine stark Säure!