[Chemie] Wie kommt man auf die Verhältnisformel PCl3?
Guten Abend,
wie kommt man auf die Verhältnisformel PCl3 (die 3 ist tiefgestellt), also Phosphorchlorid?
Hierbei muss es doch immer so sein, dass die Oktettregel bzw. die Edekgaskonfiguration eingehalten wird, also dass es 7 Valenzelektronen gibt, oder?
Wie wird das dann hier überhaupt gemacht? Welches Element gibt hier Elektronen ab und welches Element nimmt hier Elektronen auf?
Ich freue mich über eure Hilfe.
Und wie ist es zum Beispiel bei SF6 (die 6 ist tiefgestellt), also Schwefelhexafluorid? Wie wird hier die Edelgaskonfiguration bzw. die Oktettregel erreicht?
Die Halogene können mit fast allen Elementen reagieren und Verbindungen eingehen. Aber wird immer die Edelgaskonfiguration bzw. die Oktettregel erreicht? Muss immer die Edelgaskonfiguration bzw. die Oktettregel erreicht sein, damit man sowas überhaupt als Verhältnisformel/Salzformel schreiben kann? In welchen Fällen muss immer die Edelgaskonfiguration bzw. die Oktettregel erreicht werden? Wann ist das so? Ist das immer so? Ist das nicht immer so? Wovon hängt das ab? Ich freue mich über eure Erklärungen sehr.
4 Antworten

Hi,
wie kommt man auf die Verhältnisformel PCl3 (die 3 ist tiefgestellt), also Phosphorchlorid?
Ich versuche die mal, ein "Patentrezept" mitzugeben, an dem du dich langhangeln kannst:
- Du schaust in das Periodensystem der Elemente und schaust, in welcher Hauptgruppe die beteiligten Atome überhaupt stehen. Phosphor steht in der 5. Hauptgruppe und Chlor in der siebten Hauptgruppe.
- Dann notierst du, wie viele Valenzelektronen (Anzahl Elektronen auf der äußersten Schale) beide Elemente haben. Das entspricht der Hauptgruppenzahl, also bei Phosphor 5, bei Chlor 7 Valenzelektronen.
- Dann schaust du, wie viele Bindungsstellen bei jedem der Elemente frei sind. Es kann helfen, die Lewis-Formeln der Atome zu zeichnen. Dann wird dir auffallen, dass bei Phosphor noch drei Bindungsstellen frei sind, bei Chlor nur eine (der Rest sind Elektronenpaare, die keine Bindung eingehen).
- Nun schaust du, wie viele Chlor-Atome an ein Phosphoratom binden können, wenn bei Phosphor noch drei Bindungsstellen frei sind, bei Chlor aber nur noch eine. Dann kommst du darauf, dass drei Chlor-Atome an ein Phosphoratom binden können.
- Daraus ergibt sich die Verhältnisformel PCl3.
Hierbei muss es doch immer so sein, dass die Oktettregel bzw. die Edekgaskonfiguration eingehalten wird, also dass es 7 Valenzelektronen gibt, oder?
Fast richtig, beim Oktett (octo = 8) müssen es 8 Elektronen sein (außer in der 1. Periode, da nur 2). Bei PCl3 kommen beide Atome auf ein Elektronenoktett durch die bindenden Elektronenpaare.
Wie wird das dann hier überhaupt gemacht? Welches Element gibt hier Elektronen ab und welches Element nimmt hier Elektronen auf?
Hier bildest du kein Salz, sondern eine Verbindung die kovalente Bindungen hat. Da ist nicht wirklich was mit "abgeben" und "aufnehmen" von Elektronen wie bei Salzen. Du kannst zwar sagen, dass Phosphor drei Elektronen abgibt und je ein Chlor ein Elektron aufnimmt, allerdings handelt es sich hier um kovalente Bindungen, bei denen es maximal eine Verschiebung der bindenden Elektronenpaare hin zum elektronegativeren Element gibt.
Als Faustregel kannst du dir merken: Das Element, das weiter links steht, gibt die Elektronen ab, das weiter rechts nimmt die Elektronen auf.
Und wie ist es zum Beispiel bei SF6 (die 6 ist tiefgestellt), also Schwefelhexafluorid? Wie wird hier die Edelgaskonfiguration bzw. die Oktettregel erreicht?
SF6 ist ein Fall für sich. Vermutlich würdest du es wohl so zeichnen:
Das ist aber nur die halbe Wahrheit und würde mit dem obigen Vorgehen auch gar nicht funktionieren, nach dem Schwefel nur zwei Bindungsstellen hat. Bei Elementen ab der 3. Periode kann die sogenannte "Hypervalenz" auftreten - dabei kann ein Element auf der äußersten Schale mehr als 8 Elektronen haben. Warum es dazu kommt, ist ein Thema fürs Chemiestudium. Hier hast du eine sogenannte "Mehrzentren-Bindung":
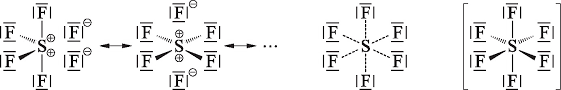
Deshalb gibt es auch so lustige Stoffe wie PCl5, obwohl Phosphor ja eigentlich nur drei freie Bindungsstellen hat.
Die Halogene können mit fast allen Elementen reagieren und Verbindungen eingehen. Aber wird immer die Edelgaskonfiguration bzw. die Oktettregel erreicht?
Na ja, für die Halogene schon ;-) für die anderen Elemente sieht es teilweise anders aus, siehe oben.
Muss immer die Edelgaskonfiguration bzw. die Oktettregel erreicht sein, damit man sowas überhaupt als Verhältnisformel/Salzformel schreiben kann?
Nein, das gilt streng genommen nur bis zur zweiten Periode.
In welchen Fällen muss immer die Edelgaskonfiguration bzw. die Oktettregel erreicht werden? Wann ist das so? Ist das immer so? Ist das nicht immer so? Wovon hängt das ab?
Ich sag es mal so: Auf dem Niveau, auf dem ihr in der Schule operiert, immer. Die ganze Wahrheit ist aber eben, dass die Oktettregel in den höheren Perioden nicht mehr zwangsweise gelten muss.
LG

Hierbei muss es doch immer so sein, dass die Oktettregel bzw. die Edekgaskonfiguration eingehalten wird, also dass es 7 Valenzelektronen gibt, oder?
8 Elektronen. Und das ist auch so. Phosphor hat 5 Valenzelelektronen, Chlor 7. Analog zum NH3 kommt man hier zum PCl3. Phosphor fehlen 3 Elektronen, es bildet daher 3 Einfachbindungen zu den 3 Chloratomen aus.
SF6 ist ein Sonderfall, genauso wie PF5 oder H2SO4. Hier kommt das Phänomen der Hypervalenz bzw. Oktetterweiterung zum Tragen. Formal kann man die Verbindung immer noch so zeichnen, dass die Oktettregel erfüllt bleibt:
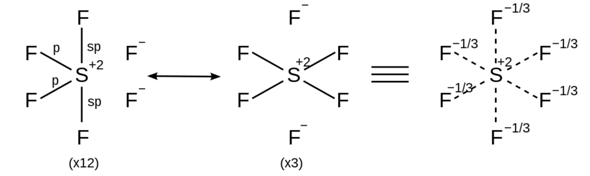
Das beschreibt auch die reale Bindungssituation (etwas) besser, da es hier Mehrzentrenbindungen gibt.
Die Oktettregel gilt streng nur für Elemente der 2. Periode. Danach kann es zu solchen Oktetterweiterungen kommen. Aber solange du die paar wenigen Ausnahmen (die in der Schulchemie eine Rolle spielen) auf dem Schirm hast, kann man die Oktettregel ansonsten eigentlich auch gut für die schwereren Hauptgruppenelemente anwenden.

Vielen lieben Dank für deine Antwort, schau dir sehr gerne noch meine neuste Frage an. Dort habe ich ein paar Fragen über das Kathodenstrahlrohr und das Kanalstrahlrohr gestellt. https://www.gutefrage.net/frage/chemie-unterschied-zwischen-kathodenkanalstrahlrohr
Liebe Grüße
maennlich2002

Da kommt man überhaupt nicht drauf. Es gibt PCl₃ und PCl₅ und zumindest als Schüler kann man nicht erkennen, unter welchen Bedingungen welches gebildet wird.

Die Ottettregel gilt streng genommen nur für die Elemente der ersten 2 Perioden. Die anderen können abweichen
Da bei der 3. Periode die d-Orbitale dazukommen welche besetzt werden können.
Diese besagt das ein Atom in seiner Bildung 8 Elektronen haben will, also Edelgas Konfiguration. Wenn wir uns ein Bild von PCl3 angucken sehen wir das es 8 Elektonen hat. ( 2 sind als nichtbindendes Elektronenpaar vorhanden)
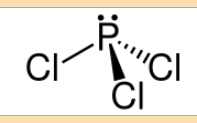
Das Verhalten vom Schwefel in falle von SF6 nennt man auch Hypervalenz.

Heist das dann das die Schreibweise mit den 6 Bindungen Falsch ist ?

Eigentlich ja, aber anders kann mans halt nicht wirklich gut zeichnen. Da kommt der Lewis-Formalismus an seine Grenzen. Daher zeichnet man es so, muss sich aber dessen bewusst sein, dass das nicht so ganz der Wahrheit entspricht.

Vielen lieben Dank für deine Antwort, schau dir sehr gerne noch meine neuste Frage an. Dort habe ich ein paar Fragen über das Kathodenstrahlrohr und das Kanalstrahlrohr gestellt. https://www.gutefrage.net/frage/chemie-unterschied-zwischen-kathodenkanalstrahlrohr
Liebe Grüße
maennlich2002
Moment, das mit der d-Orbital-Beteiligung ist schon ewig widerlegt. Das gibt es bei Hauptgruppenelementen nicht.