Chemie Phosphatgruppe
Hi, Unter den Funktionellen gruppen, gibt es die Phosphatgruppe. Das Phosphat bindet an 4 Sauerstoff Atome. Eine Sauerstoffatom wird sogar mit einer Doppelbindung gehalten. folglich habe ich 5 Bindungen! das bedäutet ja 10 Elektronen? Ich dachte ein Atom will nur eine volle Ausenschale bekommen (8 Elektronen) Warum bildet Phosphat, welches in der 5.hauptgruppe ist dann 5 bindungen? Ich dachtees würde hochstens 3 eingehen :\ siehe BIld
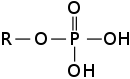
4 Antworten

P steht in der 5. Hauptgruppe. Um ein Oktett zu erreichen, kann er also (theoretisch) 5 e- abgeben oder 3e- aufnehmen. Im Phosphat hat P 5 kovalente, aber stark dipolige Bindungen zum O, das die e- zu sich zieht. P tritt also im Einklang mit der Oktettregel mit der Oxidationszahl +5 auf. Der "metallische Charakter" der Elemente, also das Bestreben, in Verbindungen e- abzugeben und ionische Verbindunen einzugehen, nimmt im PSE von links nach rechts ab, also ist Na ein typisches Metall, während die Halogenide typische Nischtmetalle sind. P steht dazwischen, es kann entweder e- abgeben oder aufnehmen.
http://www.guidobauersachs.de/anorg/fuenfte.html
Phosphor bildet mit sehr vielen Nichtmetallen kovalente Verbindungen. Dabei kommt er in allen Oxidationsstufen zwischen –3 und +5 und den Koordinationszahlen 1 bis 6, meist 3 bis 4, vor. Die Oxidationszahlen –3 und +5 sind dabei bevorzugt. Wasserstoffverbindungen
Mit Sauerstoff bildet Phosphor verschiedene Verbindungen, da Phosphor in mehreren Oxidationsstufen vorliegen kann. Dabei sind sowohl Phosphor-Sauerstoff-Einfachbindungen als auch Doppelbindungen sowie verbrückende Phosphor-Sauerstoff-Phosphor-Bindungen möglich.

ich bin das drecksfach mittlerweile los: 1 kann ich dir sagen... Man muss die Theorie an die Praxis anpassen. Hier gibt es also viele variablen, wieso der Phosphor 5 variablen haben kann: eine währe, weil er gasförmig ist...
Zum Bild: Phosphordampf: urch die hohe temperatur überwiegen P2-Moleküle mit stickstoffanaloger Valenzelektronenstruktur



Chemie scheint ja nicht dein Lieblingsfach gewesen zu sein, wenn ich nach deiner Aussage gehe... Und was willst du mit deinen Variablen? Und wieso erklärt dein P2-Molekül, dass Phosphor im Phosphat 5 Bindungen eingeht?

Du hast keine Ahnung!
Schon mal was vom Orbitalmodell gehört.
--> Nein, dacht' ich mir's doch

Man sollte sich nicht zu Fragen äußern, von denen man selber schon sagt, dass man keine Ahnung hat.

Richtig. Die Darstellung mit Doppelbindung ist auch nicht ganz sauber, in Wirklichkeit liegt im Molekül Mesomerie vor; außerdem wäre der beste Weg, vier Einfachbindungen zu schreiben, am einzelnen Sauerstoff eine negative und am Phosphor eine positive Ladung. Damit vermeidest Du die von Dir richtig erkannte Oktettüberschreitung, die früher überall gepredigt wurde und die nach neueren Untersuchungen nicht so stimmt.

Hi, das lustige bei dieser Achterregel ist, dass sie nicht di Regel, sondern viel mehr die Ausnahme ist. Sie gilt nämlich eigentlich nur für die 2. Periode im PSE, ab der dritten Periode können die Atome auch mehr Bindungen eingehen. Hierbei sind dann die d-Orbitale beteiligt (falls dir Orbitale noch nichts sagen, die dritte Schale darf ja 18 Elektronen aufnehmen. Die d-Orbitale bilden den Nebengruppenblock, hier ist Platz für 10 Elektronen)
Hoffe ich konnte deine Verwirrung etwas sortiren, lG Chris

Strebt ein Phosphoratom 9 Kovalente Bindungen an?
Nein, Phosphor ist durch die mögliche Beteiligung von d-Orbitalen zwar sehr flexibel, aber wie kommst du auf 9 kovalente Bindungen?? Phosphor ist in der 5.HG und kann maximal 5 Bindungen eingehen, da die Hauptgruppennummer bekanntlich die Anzahl der Valenzelektronen angibt - bei P also höchstens 5!! Mit entscheidend sind auch Energiebetrachtungen sowie die günstigst-möglichste geometrische Anordnung, die Einfluss auf ein eventuelle Beteiligung von d-Orbitalen haben.
Können die Atome der 2. Periode auch mehr als 4 Kovalente Bindungen eingehen?
Meines Wissens wurden mehr als 4 kovalente Bindungen für Elemente der 2. Periode noch nicht nachgewiesen, auch wenn es rechnerische Energiebetrachtungen dazu gibt http://en.wikipedia.org/wiki/Nitrogen_pentafluoride

Das mit der „Beteiligung von d-Orbitalen“ ist so einfach nicht, ich würde eher sagen, daß man die aus der Erklärung draußenlassen sollte. Man kann die Formel ja auch mit einer Donor–Akzeptor-Bindung schreiben, dann hat man nur 8 Außenelektronen für so ein Phosphat. Die analoge Formel beim Stickstoff funktioniert aber trotzdem nicht.
Aber Du hast auf jeden Fall recht, wenn Du schreibst, daß die erste Achterperiode die Ausnahme ist. ;-)
Danke! Deine Antwort hat mir sehr geholfen. Ja Orbitale sagen mir etwas, habe den Stoff aus der Vorlesung aber noch nicht wiederholt und bisher soweit ich weis nur von s und p Orbitalen gehört.
Du konntest mich sortieren, ganz "verstanden" habe ich es aber immer noch nicht. Leider habe ich Chemie in der 10. Klasse abgewählt und beschäftige mich erst jetzt (über 3 Jahre später) erst wieder damit.
Strebt ein Phosphoratom 9 Kovalente Bindungen an? Können die Atome der 2. Periode auch mehr als 4 Kovalente Bindungen eingehen? oder gilt dort immer die Achterregel? (z.B. Kohlenstoff)