Kann mir jemand die Ionenbildung erklären (evtl mit Beispiel)?
Hallo,
Ich schreibe morgen einen Chemietest, der über die Ionenbildung geht. Wie werden Ionen gebildet? Ich weiß, dass Außenelektronen (Hauptgruppen im Periodensystem) zwischen 1-3 (evtl auch 4), Elektronen abgeben müssen und positive Atome entstehen, und dass 5-7 aufnehmen und negative Atome entstehen. Nur wie weiß ich, wieviele Atome ich abgeben bzw. aufnehmen muss? Lösungen eines Aufgabenblattes:
ABGABE
Aluminium (13 Elektronen und ein Metall, 3 Außenelektronen) --> gibt ab, positiv +3 --> Zustand: Neon (10 Elektronen und ein Nichtmetall, somit in der 8. und letzten Hauptgruppe sprich es ist im Edelgaszustand).
AUFNAHME
Fluor (9 Elektronen und ein Nichtmetall, 7 Außenelektronen) --> nimmt auf, negativ -1 --> Zustand: Neon (10 Elektronen und ein Nichtmetall, somit in der 8. und letzten Hauptgruppe sprich es ist im Edelgaszustand).
Danke im Voraus :) (Nehmt euch am besten ein Periodensystem zur Hand :D)
2 Antworten

Unter einem Ion versteht man ein elektrisch geladenes Atom oder Molekül.
Als Beispiel werde ich hierbei auf Natriumchlorid (Kochsalz) zurückgreifen.
Das Periodensystem gibt uns aufschluss darüber, wie viele Valenzelektronen unsere Edukte, also Chlor und Natrium haben.
Hierbei greifen wir auf das bohrsche Schalenmodell zurück.
Die Zahl der Valenzelektronen können wir aus der Hauptgruppennummer ablesen, wobei dies bei Nebengruppenelementen nicht so einfach funktioniert und wir auf Oxidationszahlen zurückgreifen müssen, sofern uns eine Summenformel genannt wurde.
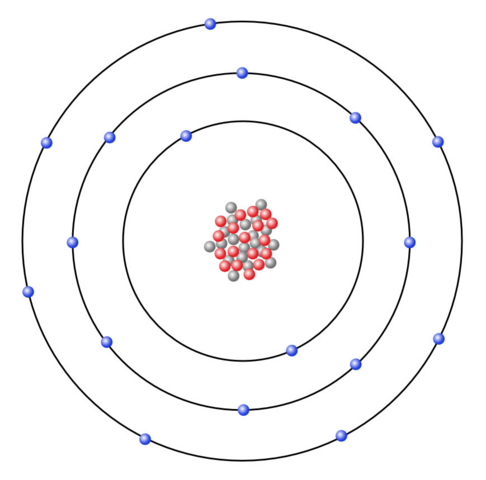
Aus der Hauptgruppennummer des Natriums geht hervor, dass das Natriumatom ein Valenzelektron besitzt.
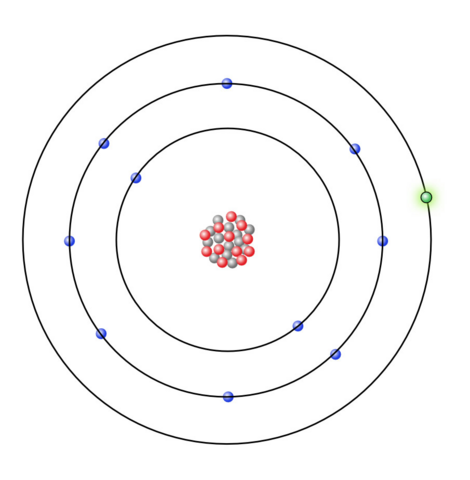
(Quelle: https://www.u-helmich.de/che/0809/04-Ionen/Ionenbindung-02.html)
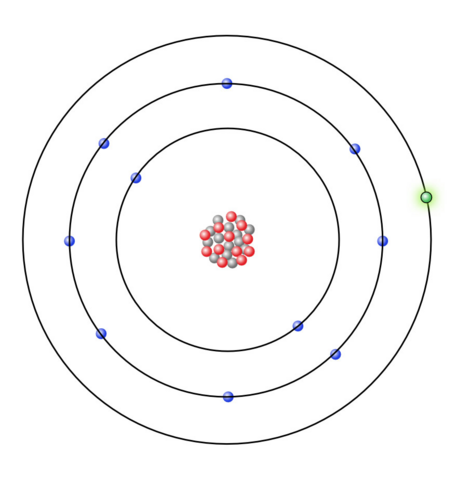
Chlor steht in der siebten Hauptgruppe, weswegen das Chloratom sieben Valenzelektronen besitzen muss.
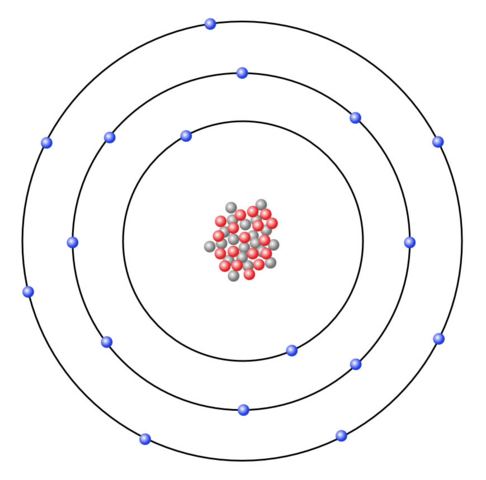
(Quelle: https://www.u-helmich.de/che/0809/04-Ionen/Ionenbindung-02.html)
Beide Atome wollen die Edelgaskonfiguration erreichen, das heißt, dass die Atome anstreben, dass ihre äußerste Elektronenschale acht Elektronen beinhalten, wobei es hier auch Ausnahmen gibt, wie beispielweise Wasserstoff oder Lithium, welche schon mit zwei Valenzelektronen die Edelgaskonfiguration erreichen.
Da dem Natriumatom sieben Valenzelektronen fehlen würden, damit die äußerste Schale voll besetzt ist, neigt es dazu, ein Valenzelektron abzugeben, anstatt sieben Valenzelektronen aufzunehmen, wobei dies beim Chloratom gerade andersherum ist, da dieses sieben Valenzelektronen besitzt, wird es eher ein Elektron aufnehmen, anstatt sieben Valenzelektronen abzugeben.
Nun wissen wir, wie viele Valenzelektronen unsere beteiligten Stoffe haben, weswegen wir anfangen können, die Ladungen der einzelnen Stoffe zu erarbeiten.
Da das Natriumatom ein negativ geladenes Elektron abgibt, herrscht ein ungleiches Verhältnis zwischen Elektronen und Protonen, da wir nun ein Proton mehr als ein Elektron haben, weswegen wir auch eine positive Ladung mehr haben.
Da das Natriumatom bei der Reaktion ein Elektron abgibt, damit dieses die Elektronenkonfiguration erreicht, liegt ein Natriumkation vor, welches die Ladung +1 besitzt.
Am besten kann man sich das Ganze anhand einer Gleichung vorstellen.
Hierbei repräsentiert die 0 den vorherigen Zustand des Atoms, wobei ein Elektron (-1) abgegeben wird.
Beim Chloratom ist das Ganze wieder andersherum, da das Chloratom ein Elektron aufnimmt, damit dieses die Elektronenkonfiguration erreicht, liegt ein Chloranion vor, welches die Ladung -1 besitzt.
Das heißt, dass das Atom ein Elektron mehr hat als ein Proton, weswegen hier eine negative Ladung vorliegt.
Auch das kann man mithilfe einer Gleichung darstellen.
Hierbei repräsentiert die 0 den vorherigen Zustand des Atoms, wobei ein Elektron (-1) aufgenommen wird.
Da wir nun die Ladungen ermittelt haben, können wir auch noch eine Reaktionsgleichung aufstellen, bevor wir eine Redoxreaktionsgleichung aufstellen.

Hierbei müssen wir beachten, dass Chlor molekular vorliegt, also zweiatomig, weswegen die Reaktionsgleichung auch dementsprechend ausgeglichen werden muss.
Nun sind wir auch in der Lage die dazugehörige Redoxreaktionsgleichung aufzustellen, da wir die Ladungen bereits ermittelt haben.
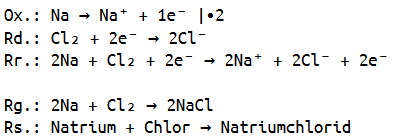
Hierbei müssen wir selbstverständlich wieder beachten, dass Chlor molekular vorliegt und somit die Oxidation (Elektronenabgabe) des Natriums mit zwei multiplizieren, damit alles ausgeglichen ist.
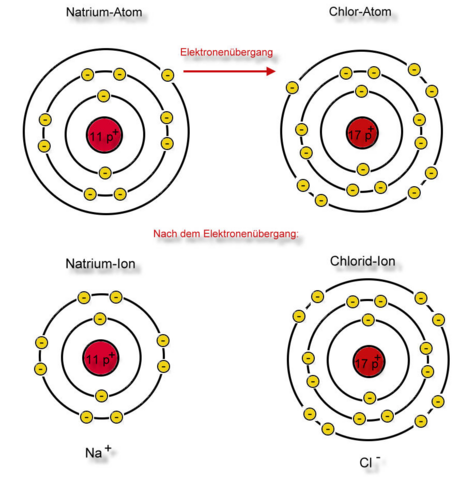
Das Ganze würde folgendermaßen im Schalenmodell aussehen:
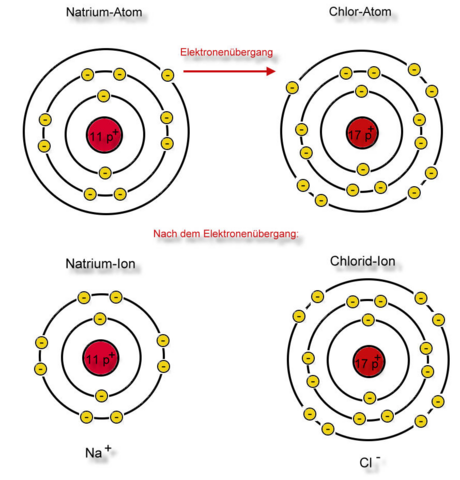
Nun haben wir den Weg von Natrium und Chlor zu Natriumchlorid (Kochsalz) nachvollzogen und erarbeitet, was mit den Valenzelektronen geschieht.
~Johannes

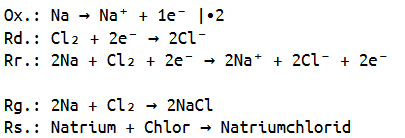

*Diese Ionen bilden dann ein sogenanntes Ionengitter aus, welches unter anderem durch die Coulomb-Kräfte, welche durch die Ladungen (+ und -) entstehen, einen sehr starken zusammenhalt hat.
Deswegen sind die Schmelz- und Siedetemperaturen von Salzen auch dementsprechend hoch.
~Johannes

Deine Beispiele scheinen doch gut zu erklären, woher man das weiß.
Insgesamt sollte die Elektronenaufnahme- oder Abgabe dazu führen, dass das Atom die Edelgaskonfiguration erreicht.