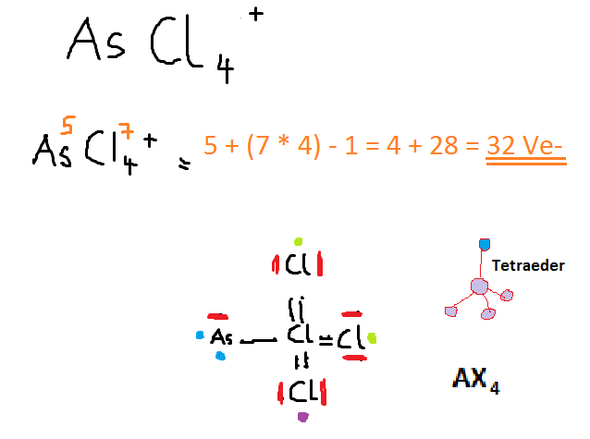AsCl 4+ Molekulare Geometrie (VSEPR) ?
Hallo,
wie ermittle ich die molekulare Geometrie von AsCl 4+? Bzw. habe ich es richtig gemacht?
Ich weiß, dass ich zunächst erst die Lewis Struktur ermitteln muss.
As hat 5 Valenzelektronen, Cl hat 7 Valenzelektronen. Davon ziehe ich 1 ab, da es sich um ein positives Ion handelt.
-> 5-1 + (7x4) = 32 Valenzelektronen
Da es sich bei Cl um das negativste Element handelt, wird dieses das Zentralatom bilden. Da die anderen 3 Cl auch die Elektronen anziehen, werden sie dem Zentralatom näher stehen als das As und somit eine tetraedische Form bilden.
Das Zentralatom besitzt 3 Doppelbindungen und 1 Einfachbindung und besitzt selbst kein freies Elektronenpaar ---> AX4. Dies würde die Tetraeder-Form bestätigen.
Stimmt diese Annahme?
Ich bin etwas eingerostet, was Chemie anbelangt... Die freien Elektronen von den "umgebenden" 3 Cl und dem As sind egal, oder? Nur das Zentralatom ist wichtig, oder?
Danke schon mal im Voraus!
Grüße, bracedface