Zahlen vor der Reaktionsgleichung?
Hallo Community,
durch das Homeoffice haben wir angefangen neue Themen Online zu erarbeiten in der Schule. Das einzige Fach wo ich mich ein bisschen schwer tue ist Chemie. Unten füge ich mal ein Bild einer Lösung ein, welche uns die Lehrerin geschickt hat für eine Aufgabe wo wir Reaktionsgleichungen aufstellen sollten.
Kann mir jemand erklären was es mit den Zahlen vor den Edukten auf sich hat, bzw wie man sie berechnet/auf sie kommt. Als Beispiel: 8Ag
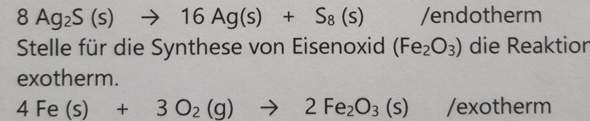
3 Antworten

Weil du hinten hinterm S auch eine 8 stehen hast und deshalb auch vorm edukt eine 8 schreiben muss um auf die selbe Anzahl zu kommen wenn du mal nachrechnest sind jetzt auf der edukt sowie Produktseite gleich viele Moleküle.
Wenn du diese Grundlage nicht beherrscht , Rraktionsgleichungen ausgleichen das auf jeder Seite gleich viele Moleküle sind würde ich das nochmal dringend üben. Ist so ein standart ding was man immer gebrauchen wird in der chemie

Die Zahlen geben quasi an, wie Oft dieses Molekül in der Reaktionsgleichung vorkommt.
Normalerweise würde da ja stehen:
Ag2S -> Ag + S8
Die Zahlen muss man zum "Ausgleichen" benutzen.
Wir sehen, dass Schwefel 8 mal vorkommt.
Da bei Ag2S allerdings nur ein S ist muss man die 8 davor schreiben, da jedes vorhandene Molekül ja irgendwie wieder verwendet werden muss.
Durch 8Ag2S wissen wir dann, dass 8 mal Ag2 vorkommt, also müssen wir vor Ag eine 16 schreiben.
Am Ende muss immer ein "Gleichgewicht" sein.
Die kleinen tiefgestellten Zahlen zeigen nur, wie oft dieser Stoff quasi in dem Molekül vorkommt und die Zahlen davor, wie oft man das komplette Molekül in der Reaktionsgleichung braucht.

Hallo Alex5975818
Schwefel kommt als Element in verschiedenen Formen/Modifikationen vor. Die stabilste dabei sind gewellte Ringe aus 8 Schwefel-Atomen.
Vielfach wird in Reaktionsgleichungen für Schwefel das einfache Symbol S eingesetzt. Hat man sich aber entschlossen, diese S₈-Ringe auch in einer Gleichung zu verwenden, muss man dies in der Gleichung auch berücksichtigen:
Ag₂S → 2 Ag + S₈
Hier hat man rechts 8 S-Atome, die auf der linken Seite ebenfalls auftauchen müssen:
8 Ag₂S → 2 Ag + S₈
Und da jetzt 8 Ag₂S eingesetzt werden, muss die Anzahl an Ag-Atomen ebenfalls angepasst werden:
8 Ag₂S → 16 Ag + S₈
Zählt man die Atome links und rechts, so sind auf beiden Seiten gleich viele vorhanden und die Reaktionsgleichung ist korrekt.
Bei der Reaktion
4 Fe + 3 O₂ → 2 Fe₂O₃
muss man als Voraussetzung wissen, dass Eisen 2- und 3-wertig auftreten kann und die Ionen Fe²⁺ und Fe³⁺ bildet. Und man muss wissen, dass der Sauerstoff elementar als O₂-Molekül vorliegt und in Verbindungen meist 2-wertig als O²⁻ auftaucht.
Nun gibt es zwei Möglichkeiten, diese Ionen zu kombinieren.
Fe²⁺ und O²⁻ lassen sich leicht kombinieren, da beide Ionen die gleiche, aber entgegengesetzte Ladung haben:
Fe²⁺ + O²⁻ → FeO
Und als Reaktionsgleichung:
2 Fe + O₂ → 2 FeO
Bei der Kombination von Fe³⁺ und O²⁻ ist es nicht mehr so einfach, weil die Ionen zahlenmäßig unterschiedlich sind. Hier hilft das kleinste gemeinsame Vielfache KgV. Das KgV von 2 und 3 ist 6. Als muss man 2 mal die Ladung 3+ (= +6) mit 3 mal der Ladung 2- (= -6) ausgleichen:
2 Fe³⁺ + 3 O²⁻ → Fe₂O₃
Und wieder als Reaktionsgleichung:
2 Fe + 1.5 O₂ → Fe₂O₃
Die 'halben' O₂-Moleküle kann man durch Verdopplung der Gleichung in ganze Moleküle verwandeln:
4 Fe + 3 O₂ → 2 Fe₂O₃
OK?
LG