Wie funktioniert Aluminiumoxid auf der Teilchenebene?
Hallo, in Chemie machen wir gerade Elektronenpaarbindung und haben als Hausaufgabe das mit Oxidation von Metalle zusammenzuführen, spezifisch auf Aluminiumoxid bezogen.
Da Aluminium ein Element der dritten Hauptgruppe ist, hat es drei Valenzelektronen und mit der Elektronenpaarbindung kann es pro eigenes Elektron ein weiteres geteiltes besitzen, also höchstens 6. Der ganze Sinn der Elektronenpaarbindung ist aber, dass ein Atom eine volle Schale hat, was Aluminium nicht bei der Verbindung mit Sauerstoff erhalten wird.
Meine Frage ist, warum Aluminium eine Verbindung mit Sauerstoff eingeht, die dem Ziel und Prinzip der Bindung widerspricht. Ist Aluminium ein Sonderfall und wenn ja, wie sieht es bei anderen Atomen der dritten Hauptgruppe aus?
Ich freue mich über jede Antwort, habt einen schönen Tag.
2 Antworten

Im Aluminiumoxid liegt keine Elektronenpaarbindung, sondern eine Ionenbindung vor. Aluminium besitzt 3 Valenzelektronen. Sauerstoff besitzt 6 Valenzelektronen. Aluminium besitzt eine Elektronegativität von 1,61 und Sauerstoff eine von 3,44. Damit zieht Sauerstoff die Elektronen stärker zu sich. Aluminium tritt seine 3 Valenzelektronen vollständig ab. Dadurch erlangt es die Elektronenkonfiguration des vorherigeren Edelgases Neon. Sauerstoff nimmt 2 Elektronen auf und erlangt so die nächst höhere Edelgaskonfiguration, ebenfalls jene des Neons. Bei einer Ionenbindung werden keine Elektronen geteilt. Aluminium verliert die Valenzelektronen komplett und liegt dann als dreifach positiv geladenes Aluminium-Ion vor. Sauerstoff als zweifach negativ geladenes Oxid-Ion. Die Ionen ordnen sich dann in einem Gitter an und zwar so, dass Kationen immer von Anionen umgeben sind und Anionen von Kationen, wodurch sie sich gegenseitig stabilisieren.
Für Al2O3 existieren mehrere Strukturen, eine ist die sogenannte Korund-Struktur:
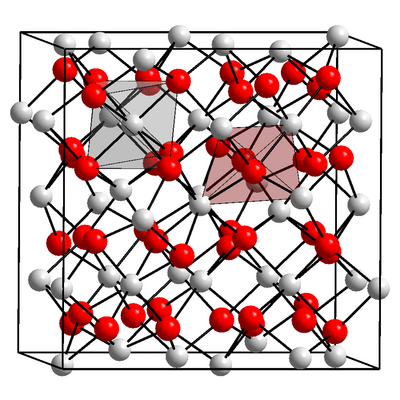
Das hier ist ein kleiner Ausschnitt aus der Struktur, in Wirklichkeit sind solche Kristallgitter viel größer. Die roten Kugeln sollen Aluminium-Ionen darstellen, die weißen Kugeln Oxid-Ionen.

dass ein Atom eine volle Schale hat, was Aluminium nicht bei der Verbindung mit Sauerstoff erhalten wird.
Wie kommst du darauf? Aluminiumoxid ist ein Salz, hat also ionische Bindungen. Dementsprechend gibt Al seine drei Elektronen komplett an den Sauerstoff ab und erhölt damit seine volle Schale.