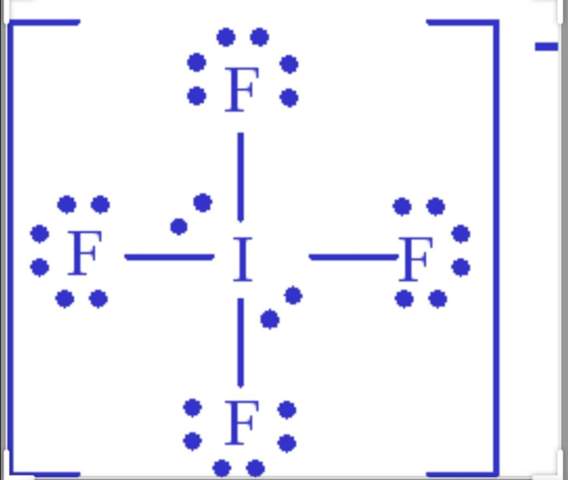
Wenn mir die Summenformel IF4^- gegeben wird, wie finde ich dann heraus dass die Strukturformel so aussieht👇(ohne es nachzuschauen)?
Ich wusste z. B. nicht dass Iod zwei freie Elektronen Paare hat. Wie kann man das aus der Summenformel ableiten?
3 Antworten

Iod hat 7 Elektronen in der Außenschale, dazu kommt eines wegen der negativen Ladung des IF₄⁻, ergibt 8.
4 davon bilden je eine Einfachbindung zu den 4 F-Atomen, bleiben 4 übrig. Die bilden dann 2 freie Elektronenpaare.
Analog bildet sich in der Oxidationsstufe +5 IF₆⁻ mit einem freien Elektronenpaar und in der Oxidationsstufe +7 IF₈⁻ mit ohne freiem Elektronenpaar.

Iod und Flour sind in der 7 Gruppe des Periodensystem. Sie können 7 Bindungen eingehen.(das sind die Punke und Striche)
das ganze Molekül ist negativ geladen da Iod in der Mitte ein elektron zu viel hat. Elektronen sind negativ geladen.

Hä, aber hätte das Iod auf dem Bild dann nicht 4 Elektronen zu viel.. Ich verstehe das nicht ganz 😅

Das kann man nur wissen, wenn man sich mit der Orbitaltheorie beschäftigt hat.
Iod kann, vereinfacht ausgedrückt, mehr als acht Elektronen anbieten, oder hat für Bindungselektronen mehr Platz und hört nicht wirklich auf die Valenzregel.

Das kannst Du leicht selbst herausfinden. Iod ist in der 5. Periode und hat somit "Zugang" zu den Elektronen der Nebengruppen. Anders formuliert: Es stehen s,p und d-Orbitale zur Verfügung. Wenn Du berücksichtigst, dass die s-Orbitale Platz für zwei Elektronen, die p-Orbitale Platz für 6 Orbitale und die d-Orbitale Platz für zehn Elektronen haben, hast Du Deine Antwort.
Und wie viele Elektronen genau kann das Iod anbieten? 11 vielleicht?