Oxidation von Milchsäure?
Zeigen Sie anhand von Oxidationszahlen, dass sich Milchsäure oxidieren lässt. Geben Sie die Strukturformel des Produktes an, das sie erwarten.
Die Summenformel von Milchsäure ist C3H6O3. Die Oxidationszahlen von H und O sind ja +1 und -2. Ist dann die Oxidationszahl von Kohlenstoff 0? Und wie kann ich jetzt anhand dessen zeigen, dass es oxidiert? Bei der Oxidation werden ja Elektronen abgegeben, aber wie kann ich das jetzt anhand der Oxidationszahlen zeigen'?
Ich verstehe das ganze nicht, kann mir jemand bitte helfen? Vielen Dank!
2 Antworten

Moin,
also zunächst einmal etwas zur Bestimmung der Oxidationszahlen:
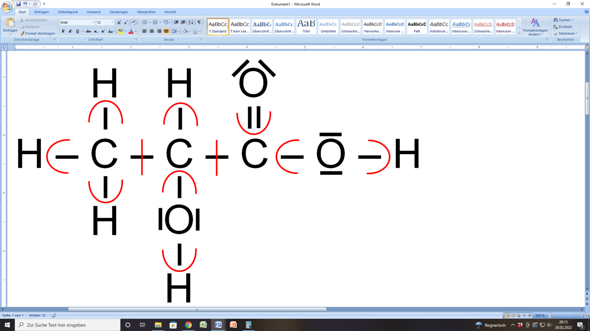
Im Bild siehst du die Strukturformel der Milchsäure (2-Hydroxypropansäure).
Wasserstoffatome haben einen Elektronegativität (EN) von 2,2.
Sauerstoff hat eine EN von 3,5 und Kohlenstoff von 2,5.
Die roten Linien zeigen nun, dass ein bindendes Elektronenpaar stets dem elektronegativeren Bindungspartner zugeteilt wird. Sind beide Bindungspartner gleich elektronegativ (das ist in den C–C-Bindungen der Fall), wird das bindende Elektronenpaar in der Mitte geteilt und jeder Bindungspartner erhält je ein Elektron aus der Bindung zugesprochen.
Nach der Zuteilung zählst du an jedem Atom die zugeteilten Elektronen und vergleichst die Anzahl mit der Valenzelektronenanzahl die ein ungebundenes Atom hätte.
Das ergibt bei allen Wasserstoffatomen im vorliegenden Fall, dass sie alle kein Elektron zugeteilt bekamen, weil die Bindungspartner immer die höhere EN haben.
Tja, der Vergleich mit einem unverbundenen einzelnen Wasserstoffatom zeigt, dass diese über ein Elektron verfügen. Wenn aber den Wasserstoffatomen in der Verbindung nach der Zuteilung kein Elektron mehr gehört, dann ist das formal so, als hätten sie alle ein Elektron abgegeben. Darum haben alle Wasserstoffatome in dieser Verbindung die Oxidationszahl +I (+1, wie du ja schon selbst festgestellt hast).
Wenn du das gleiche für die Sauerstoffatome wiederholst, stellst du fest, dass ein ungebundenes einzelnes Sauerstoffatom sechs Valenzelektronen hätte.
In dieser Verbindung haben aber alle Sauerstoffatome nach der Zuteilung stets acht Elektronen. Das ist formal so, als hätten sie alle zwei Elektronen aufgenommen. Darum haben alle Sauerstoffatome dieser Verbindung die Oxidationszahl –II (–2, was du ja ebenfalls bereits angemerkt hast).
Kommen wir also zu den Kohlenstoffatomen... Kohlenstoffatome haben im ungebundenen Zustand vier Valenzelektronen.
Nun hat das Kohlenstoffatom links in der Abbildung nach der Zuteilung aber sieben Elektronen zugesprochen bekommen. Das sind formal drei Elektronen mehr (verglichen mit einem unverbundenen C-Atom). Darum hat dieses Kohlenstoffatom die Oxidationszahl –III (–3).
Das mittlere Kohlenstoffatom hat nach der Zuteilung vier Elektronen zugesprochen bekommen. Der Vergleich mit einem unverbundenen C-Atom zeigt, dass weder ein Elektron mehr noch eines weniger vorhanden ist. Darum hat das mittlere Kohlenstoffatom die Oxidationszahl 0 (Null).
Das Kohlenstoffatom rechts hat nach der Zuteilung nur noch ein Elektron zugesprochen bekommen. Das sind formal drei weniger als im unverbundenen Zustand. Daher hat dieses Kohlenstoffatom die Oxidationszahl +III (+3).
Der Gesamt-Check ergibt dann für das gesamte Molekül die Summe aller Oxidationszahlen von
(6 • +I) + (3 • –II) + –III + 0 + +III = 0
und siehe da, Milchsäure hat als Molekül auch keine Ladung...
Wenn du Milchsäure nun oxidierst, gibt es zwei Möglichkeiten. Entweder du verbrennst sie mit Luftsauerstoff oder du oxidierst sie mit einem milderen Oxidationsmittel (bzw. enzymatisch) zu Brenztraubensäure (2-Oxopropansäure).
Im ersten Fall sieht das Reaktionsschema (einer vollständigen Verbrennung) folgendermaßen aus:
C3H6O3 + 3 O2 → 3 CO2 + 3 H2O
Im Kohlenstoffdioxid (CO2) hat der Kohlenstoff die Oxidationszahl +IV (+4). Da dies in jedem Fall höher ist als die Oxidationszahlen der drei Kohlenstoffatome in der Milchsäure (zur Erinnerung: –III, 0 und +III) werden alle Kohlenstoffatome in diesem Reaktionsschema (unterschiedlich stark) oxidiert:
C3 von –III auf +IV (Elektronendifferenz 7 e–)
C2 von 0 auf +IV (Elektronendifferenz 4 e–)
C1 von +III auf +IV (Elektronendifferenz 1 e–).
Die 12 Elektronen, die hier (formal) anfallen, werden von den drei Sauerstoffminimolekülen aufgenommen, die dabei von der Oxidationsstufe 0 jeweils auf die Oxidationsstufe –II reduziert werden...
Im zweiten Fall kannst du das formal so formulieren:
C3H6O3 + <O> → C3H4O3 + H2O
In der Brenztraubensäure sehen die Oxidationszahlen dann wie folgt aus:
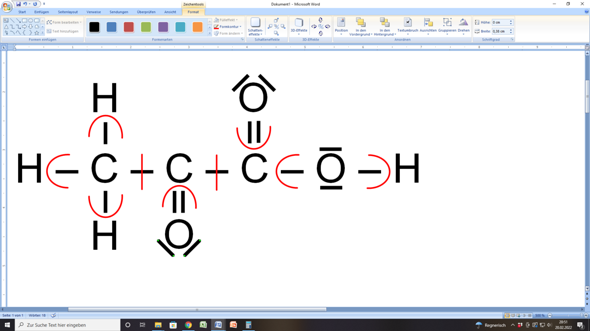
An den Oxidationszahlen der Methylgruppe (links) und der Carboxygruppe (rechts) hat sich nichts verändert. Auch der Sauerstoff an C2 hat nach wie vor die Oxidationszahl –II (–2).
Aber der mittlere Kohlenstoff hat nun eine andere Oxidationszahl als zuvor. Er hat nämlich jetzt (nach der Zuteilung) nur noch zwei Elektronen zugesprochen bekommen. Das sind im Vergleich mit den vier Elektronen bei einem unverbundenen Kohlenstoffatom zwei Elektronen weniger. Deshalb hat dieser Kohlenstoff jetzt die Oxidationszahl +II (+2). Da er zuvor im Milchsäuremolekül noch die Oxidationszahl 0 hatte, ist das formal so, als hätte er zwei Elektronen abgegeben:
C2 von 0 auf +II heißt, das zwei Elektronen abgegeben wurden (= Oxidation).
Du siehst, egal, ob du eine vollständige Verbrennung der Milchsäure oder deren milde Oxidation zur Brenztraubensäure betrachtest, stets wird wenigstens ein Kohlenstoffatom oxidiert. Und das kannst du an den Oxidationszahlen auch sehen...
LG von der Waterkant

vielen vielen Dank, du hast das ganze so gut und verständlich erklärt :D

Bei organischen Molekülen muss man die LewisStrukturFormeln zeichnen um die Oxidationszahlen am Kohlenstoff zu ermitteln.
Dann wirst Du sehen, dass es in der Milchsäure noch eine HydroxylGruppe gibt, die man zu einer KetoGruppe oxidieren kann.

Vergleiche bitte die Oxidationszahl des Kohlenstoffs in Methan, Methanol, Formaldehyd, Ameisensäure und in Kohlendioxid.

Hmm, wenn Du bisher nicht die OxZahlen von Molekülen ermitteln müsstest wird es schwer das zu erklären...aber bei Kohlenstoff ist das eigentlich Recht übersichtlich.
Im Grundzustand hat Kohlenstoff 4 Außenelektronen. Für die oxzahl zerteilt man einfach alle Bindungen und schaut, welches Atom wie viele Elektronen bekommt!
Eine C-C Bindung wird in der Mitte geteilt, beide Atome bekommen je 1 Elektron. bei C-H bekommt der Kohlenstoff beide Elektronen, der Wasserstoff keins. Dadurch hat er ein Elektron weniger als als Element und die OxStufe +I.
Bei einer C-O Bindung bekommt der Sauerstoff beide Elektronen, der Kohlenstoff keins. Da Sauerstoff das meist bei beiden Bindungen macht, hat es 2 Elektronen mehr als als Element und die OxZahl -II.
Das macht man theoretisch bei allen KohlenstoffAtomen die OxZahlen von -IV (CH4) bis +IV (CO2) annehmen können.
Zusätzlich sind reine AlkylKohlenstoffAtome nicht sehr reaktiv (-CH2-, oder -CH3), weshalb sie nur mit Brom oder Chlor reagieren.
Danke, aber wie zeigt man das denn anhand der Oxidationszahlen?