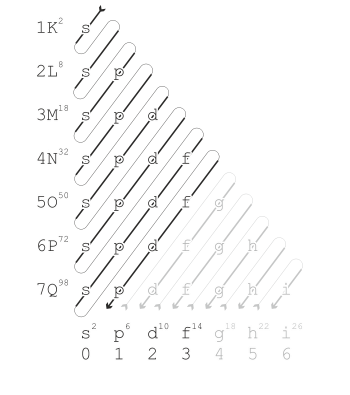Warum nur 8 Valenzelektronen bei Edelgaskonfiguration?
Warum besitzt die Edelgaskonfiguration nur 8 Valenzelektronen, wenn es ab Schale M 18 Platz hat? Es geht doch darum, dass die äusserste Schale voll sein soll.
1 Antwort

Moin,
du schreibst es...
Es geht darum, dass der äußere (!) Bereich einer Schale mit Elektronen voll besetzt ist.
Was du offenbar nicht weißt, ist, dass zwar insgesamt 18 Elektronen im dritten Hauptenergieniveau (der M-Schale) Platz finden, dass aber nur acht Elektronen davon den äußeren Bereich dieses Energieniveau ausmachen. Die zehn anderen Elektronen gehören zwar formal ebenfalls zum dritten Hauptenergieniveau, liegen aber tatsächlich in Energiebereichen, die ungünstiger sind als das erste Niveau der folgenden N-Schale. Darum werden diese Räume erst mit Elektronen besetzt, wenn der etwas günstigere Raum des vierten Hauptenergieniveaus mit zwei Elektronen vollständig besetzt wurde.
Das bedeutet, dass das dritte Hauptenergieniveau mit acht Elektronen sehr gut besetzt ist (Edelgaskonfiguration des Edelgases Argon), obwohl formal noch ungünstiger liegende weitere Räume im dritten Hauptenergieniveau zur Verfügung stehen.
Diese Unterräume werden jedoch erst nach und nach mit Elektronen besetzt (von Scandium, Sc, bis Zink, Zn) nachdem das vierte Hauptenergieniveau bereits mit zwei Elektronen besetzt worden ist (Kalium, K, und Calcium, Ca).
Wenn dann beim Zink auch das letzte Elektron das dritte Hauptenergieniveau komplettiert hat, werden dann auch die restlichen energetisch günstigen drei Räume des vierten Hauptenergieniveaus mit Elektronen befüllt, bis diese beim Krypton erneut eine gefüllte Außenschale ergeben.
Eigentlich gibt es dann im vierten Hauptenergie wieder die fünf Unterräume, die es auch schon ab dem dritten Hauptenergie gegeben hat (nur ein Hauptenergieniveau später) plus weitere sieben Unterräume, die mit Elektronen befüllt werden könnten. Doch genau wie davor schon beim dritten Hauptenergieniveau werden auch jetzt diese neuen Unterräume erst dann mit Elektronen befüllt, wenn andere Unterräume höherer Hauptenergieniveaus bereits mit Elektronen besetzt wurden.
Das liegt wieder daran, dass diese formal zu niedrigeren Hauptenergieniveaus gehörenden Unterräume tatsächlich energetisch ungünstiger liegen als bestimmte Unterräume höherer Schalen.
Die Besetzung der einzelnen Unterräume (auch Orbitale genannt) kannst du dem sogenannten Madelung-Energieschema entnehmen:
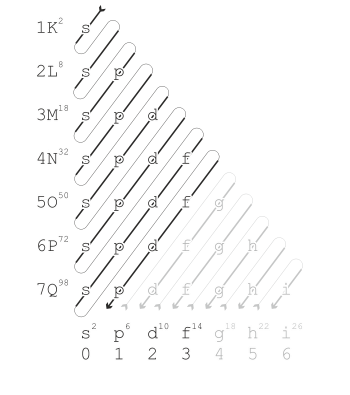
In der K-Schale gibt es ein Orbital (das s-Orbital). In jedes Orbital passen maximal zwei Elektronen. Damit ist die K-Schale voll besetzt, wenn darin zwei Elektronen sind (Edelgaskonfiguration des Elements Helium).
In der zweiten Schale (der L-Schale) gibt es auch ein s-Orbital. Außerdem gibt es hier noch drei p-Orbitale. Darum ist die L-Schale voll besetzt (Edelgaskonfiguration von Neon), wenn zwei Elektronen im s-Orbital plus sechs Elektronen in den drei p-Orbitalen untergekommen sind.
Die M-Schale hat dann ebenfalls das s-Orbital und die drei p-Orbitale. Außerdem gibt es noch die fünf d-Orbitale. Aber wie du an dem Schema sehen kannst, werden die fünf 3d-Orbitale erst mit Elektronen befüllt, nachdem das s-Orbital der nächsten Schale (der N-Schale) mit Elektronen besetzt worden ist.
Du siehst, es gibt Orbitale, die zwar formal zu einem gewissen Hauptenergieniveau gehören, die aber konkret viel ungünstiger liegen als bestimmte andere Orbitale, die formal zu höheren Hauptenergieniveaus gehören.
Das alles hat mit dem Feinbau der Elektronenhülle zu tun. Das wird im sogenannten Orbitalmodell des Atombaus thematisiert. Hinzu kommt, dass diese Besetzungen der Energieniveaus nur für Atome im energetischen Grundzustand gelten. Für Ionen kann das auch anders aussehen (zum Beispiel beim Eisenkation, das als Fe2+ oder als Fe3+ daherkommen kann und dann etwas andere Besetzungsbedingungen als ein Eisenatom Fe aufweist).
Und selbst bei den Atomen gibt es so manche Merkwürdigkeit bei der konkreten Besetzung der Orbitale im Grundzustand, wenn es sich um größere Atome handelt, die sich teilweise ganz gut erklären lassen, teilweise aber auch völlig verrückt zu sein scheinen. Ich verweise hier mal auf die Atome der Elemente Chrom, Cr, Kupfer, Cu, Niob, Nb, Molybdän, Mo, technicium, Tc, Ruthenium, Ru, Rheinium, Rh, Palladium, Pd, Silber, Ag, Lanthan, La, Gadolinium, Gd, Platin, Pt, Gold, Au, Actinium, Ac, Thorium, Th, Protactinium, Pa, Uran, U, Neptunium, Np und Curium, Cm, die alle Unregelmäßigkeiten in der konkreten Elektronenbesetzung aufweisen...
Kompliziert? - Stimmt!
LG von der Waterkant