Wann muss die Oktettregel gelten?
Ich verstehe die Fragestellung bei einem Chemie Beispiel nicht so ganz. also gefragt war: Zeichnen sie die Valenzstrichformel von Perchlorsäure und Kohlenstoffmonoxid. Muss die Oktettregel erfüllt sein oder nicht? Wenn nicht zeichnen sie einmal mit und ohne Oktett.
Ich kenne die Oktett regel, aber ich weiss nicht wie das hier gemeint ist zB perchlorsäure gilt sie hier nicht? weil Chlor ja in der 2 Periode steht und damit gilt sie dann nicht. wenn ich sie nun mit oktett zeichnen soll ich dann mit formalladungen ausgleichen? Vielen Dank schonmal
4 Antworten
Zuerst mal eine Anmerkung an die Fachleute zu den -Orbitalen: Auch wenn es so schön und plausibel aussieht, soll es nicht den Gegebenheiten entspechen, weil die d-Orbitale energetisch zu hoch liegen. Wer bin ich, das zu bezweifeln. In den neuen Lehrbüchern zur Physikalischen Chemie wird das erläutert.
@franzi:
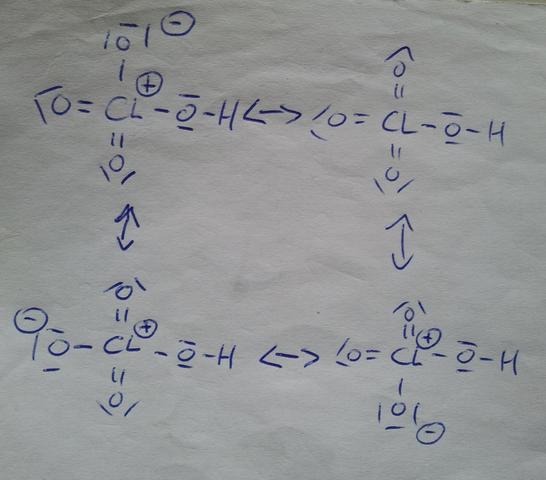
Wenn du die Perchlorsäure unter EInhaltung der Oktettregel zeichnest, bekommst du 4 Einfachbindungen zu jedem der 4 Sauerstoff. Die formale Ladung des Cl ist dann +3, die der O-Atome jewels -1, die des H +1.
Aber diese formalen Ladungen entsprechen nicht unbedingt der wirklichen Ladungsverteilung. Und es fragt sich, ob das für euch überhaupt schon ein Thema ist. Jedenfalls zieht O die Elektronen stärker an als Cl, aber nicht stärker als ein Cl mit der Ladung +1.
Und im Grunde geht es ja bei den Atombindungen gerade nicht darum, welches Atom welchem Elektronen klaut, sondern wie sie sich Elektronenpaare teilen, dass alle ihr Oktett haben.
Es gibt allerdings auch die Darstelung mit Doppelbindungen zu den O-Atomen ohne H-Anschluss. Das nennt sich Oktettaufweitung. Sowas ist bei den Übergangsmetallen normal und wurde lange auch für Elemente der 3. Periode angenommen. Ist aber wohl inzwischen überholt.
Beim CO ist die Sache etwas anders. Es hat ja wie N2 zwei Kerne mit der gleichen Gesamtladung, und auch genau so viele Elektronen. OK, der eine Kern ist positiver und der andere negativer. Solche Verbindungen nennt man auch isoelektronisch.
Also ordnen sich auch die Elektronen im CO genau so an wie im N2. Und wenn dann das O positiv geladen ist, und das C negativ, was ja genau gegen ihre Neigung ist, dann schieben sich alle bindenden Paare etwas zum O rüber.
Denn obwohl das für dich wahrscheinlich im Moment zu hoch ist, Elektronen werden nicht nur vom Kern angezogen, sie brauchen auch "Auslauf". Sie fühlen sich in weiten Räumen wohler, in dem Fall also über C und O verteilt, als bindendes Elektronenpaar.
Also:
Chlor steht in der dritten Periode und muss sich damit nicht zwingend an die Oktettregel halten. Es ist daher möglich die Perchlorsäure so zu zeichnen:
Man kann aber die Perchlorsäure durch Ladungstrennung so zeichnen, dass sie die Oktettregel erfüllt. Dabei würde jeweils ein Elektronenpaar der drei Doppelbindungen zu den Sauerstoffatomen klappen. Diese sind dann einfach negativ geladen und das Chloratom ist dreifach positiv geladen.
Was jetzt besser ist kann ich nicht wirklich sagen, dass ist auch einwenig Geschmackssache.
Beim Kohlenstoffmonoxid hast du ja nur ein Kohlenstoff- und ein Sauerstoffatom. Beide stehen in der zweiten Periode und müssen deshalb zwingend die Oktettregel erfüllen. Deshalb kann man CO nur so zeichnen:
Link siehe Kommentar zur Antwort. Gutefrage lässt leider nur einen Link pro Beitrag zu.
Ich hoffe ich konnte dir so weiter helfen.
Nein, ab der dritten Periode ist eine Oktetterweiterung (damit auch mehr als 4 Bindungen) möglich.
Nein, musicmaker hat recht und du hast das wohl falsch in Erinnerung - nicht ab der 5. Periode, ab der 3. beteiligen sich d-Orbitale. Schau dir nochmal die Bindungstheorie, auch unter Beteiligung von d-Orbitalen an.
Ich zitiere mal mein Chemie buch (mortimer) Atome der 2. Periode gehen nie mehr als 4 konvalente bindungen ein. Elemente ab der 3. periode können konv. bindungen mit mehr als vier atomen eingehen man spricht von oktett aufweitung. Mehr als 6 Bindungen kommen selten und nur bei elementen ab der 5. periode mit großen atomradien vor.
Deswegen verwirren mich diese 7 bindungen etwas, oder zählen die doppelbindungen nicht?
Heureka!!
Bei Perchlorsäure ist eine Oktettüberschreitung offenbar möglich (so etwa in der Mitte des folgenden Links)
http://de.wikibooks.org/wiki/Anorganische_Chemie_f%C3%BCr_Sch%C3%BCler/_Die_Atombindung
Ja, das mit den Theorien in den Büchern ist immer ganz nett, aber du mußt immer davon ausgehen, das Wissenschaft "lebt" und ständig neue Forschungsergebnisse mit "Aha"-Effekt präsentiert werden. So gesehen kann Herr Mortimor auch weiterhin recht haben oder fast recht haben oder vielleicht gibt es einfach -wie so oft- auch mal die ein oder andere Ausnahme, die dem Autor gerade nicht in den Sinn kam...
Die Aussage verwirrt mich einwenig. Zumindest höre ich sie das erste mal. Verbindungen wie SF6 haben auch 6 Bindungen und Schwefel steht auch nicht in der 5. Periode.
Naja aber wenn ich Franzimusik bzw. den Mortimor richtig verstehe, dann geht es um mehr als 6 Bindungen, womit SF6 noch nicht gemeint wäre...
Mehr als 6 Bindungen kommen selten und nur bei elementen ab der 5. periode mit großen atomradien vor.
Also die Oktettregel is ja das die Valenzschale komplett besetzt sein soll, das heißt, zwei ( bei Helium und Wasserstoff ) und 8 Valenzelektronen ( bei allen anderen ) haben. Perchlorsäure is ein Chlor Atom mit 3 Sauerstoffatomen mit Doppelbindung und einmal eine Hydroxylgruppe ( OH mit einfachbindung ) Ich weiß nicht wie man die Oktettregel hier nicht erfüllen soll. Eventuell wenn du die freien Elektronenpaare an den Os weglässt
ja aber gilt sie schon allein wegen dem chlor nicht nicht? oder ist das nur auf den sauerstoff bezogen? Und es sollten ja höchstens vier bindungen sein oder?
Also Sauerstoff kann insgesammt 2 Bindungen eingehen und Cl ja eigentlich nur eine... aber in diesem Beispiel sind es ja 7... hm... also ich bin mir nicht sicher, aber chemisch bekommt man das sicher hin und ich glaube das das Beispiel wirklich nur auf den Sauerstoff und dessen freie Elektronenpaare bezogen ist. Ansonsten schreib hin, dass Clor nur noch eine Bindung eingehen kann und danach der Edelgaszustand erreicht ist, also es nicht mehr weiter reagieren kann.
Die Perchlorsäure im undissoziierten Zustand. Wenn du möchtest kannst du das Ganze noch auseinanderpfriemeln zu [H]+ und [ClO4]-.
Der Punkt ist übrigens der... du kannst tatsächlich weitere Grenzstrukturen von Perchlorsäure formulieren und dabei die hier abgebildeten Elektronenpaare der Doppelbindungen sukzessive den Sauerstoffatomen übergeben, wobei die positive Ladung am zentralen Chloratom "2+" und sogar "3+" sein kann. Nur... diesen mesomeren Grenzstrukturen mit einer höheren Ladung am Chloratom misst man in der Regel kaum Bedeutung bei, mit anderen Worten, diese bilden die Realität in vernachlässigbar geringem Maße ab, darum werden diese gerne weggelassen.
Danke das war so ziemlich genau das was ich wissen wollte :) aber ich hab irgendwo gelesen das atome erst ab der 5. Periode mehr als 6 Bindungen eingehen oder irre ich mich da?