Titration berechnen?
Wir haben folgendes Experiment durchgeführt und müssen jetzt die untenstehenden Fragen beantworten leider war ich in der Stunde für die Theorie nicht da und weiß nicht im geringsten was ich tun soll. Bin für jede Hilfe sehr sehr dankbar!


1 Antwort

Hier hast Du Deine Titrationskurve, so wie Du sie gemessen haben solltest. Ich habe die Konzentration der Essigsäure so eingestellt, daß der Verbrauch genau 4.2 ml beträgt, weil das in Deinen Papieren irgendwo so steht. Man nimmt 5 ml Probe, fügt 15 ml Wasser hinzu und titriert mit 1 mol/l NaOH.
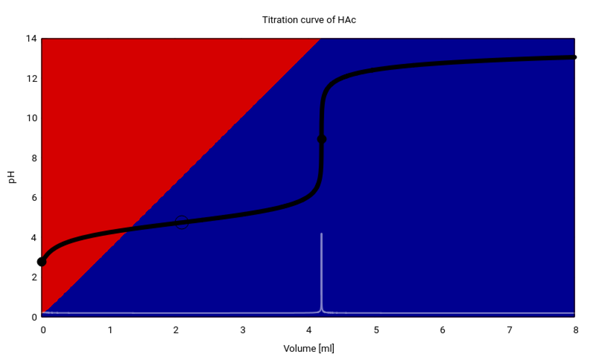
Man sieht die Titrationskurve, den Halbäquivalenzpunkt (Ring) bzw. Äquivalenzpunkt (Vollkreis), auch die erste Ableitung davon (weiß) und wie die Essigsäure (rot) im Lauf der Titration immer mehr verschwindet und dem Acetat (blau) Platz macht.
Nun zu den Fragen:
- #include <stdblabla.h>
- Wenn Du V=4.2 ml einer c=1 mol/l NaOH verbrauchst hast, dann sind das n=cV=4.2 mmol.
- Folglich waren in der Probe ebenfalls 4.2 mmol CH₃COOH enthalten.
- und die Konzentration ist c=n/V=0.84 mol/l
- Das rechnet man mit der molaren Masse um γ=cM=50.4 g/l bzw. w≈5.04%
- Das entspricht ungefähr den Literaturwerten für Haushaltsessig.

Ich habe mir dazu ein Programm geschrieben, das die Gleichgewichte punktweise löst und die Daten auf ein File schreibt, das ich dann mit Gnuplot zeichne.

Kurz mal eine Frage, wie erstellst du solche Titrationskurven?