Stärksten Oxidationsmittel und Stärksten Reduktionsmittel?
Kann mir jemand erklären wo in der redoxreihe Stärksten Oxidationsmittel und Stärksten Reduktionsmittel stehen und warum?
Ich muss bald ein Test schreiben und weiß nicht was das ist.
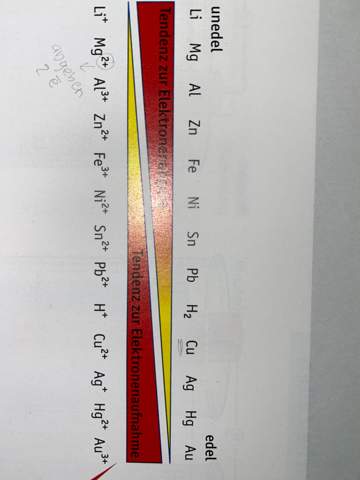
Das ist die redoxreihe
mich freue mich auf eine schnelle Antwort
2 Antworten

Wodurch sind ein Oxidationsmittel und ein Reduktionsmittel charakterisiert?
Die Lösung steht dann in den spitzwinkligen Dreiecken der Skizzen.

Das kommt darauf an wie leicht die oben gezeigten Metalle Elektronen abgeben. Das hängt mit dem Bau der Atome zusammen.
Konkret: Das Lithiumatom hat ein Elektron auf der äußeren Bohrschen Kreisbahn. Um die Edelgaskonfiguration zu erreichen, muss es "nur" dieses Elektron abgeben. Li ist somit (wie alle anderen Alkalimetalle auch) sehr reaktiv. Es gibt also sehr leicht Elektronen (gemeint ist das Element allgemein) ab und wird dabei oxidiert. Eine Oxidation läuft nur ab, wenn gleichzeitig ein anderer Stoff reduziert wird. Da also Li sehr leicht Elekronen abgibt, die ein bestimmter anderer Stoff aufnehmen kann, ist es ein starkes Reduktionsmittel.
Umgekehrt steht das Lithiumion an der entgegengesetzten Stelle des anderen Dreiecks. Es nimmt also sehr schwer ein Elektron auf, um in ein Lithiumatom überzugehen. Es ist sehr schwer das Lithiumion zu reduzieren. Es ist also ein .....?

Wie der Name sagt, reduziert ein Reduktionsmittel einen anderen Stoff. Das Reduktionsmittel gibt dabei Elektronen ab, die ein anderer Stoff aufnehmen kann.
Je leichter ein Stoff Elektronen abgeben kann, ein umso stärkeres Reduktionsmittel ist es.
Voraussetzung für einen Redoxvorgang ist natürlich, dass es einen anderen Stoff gibt, der Elektronen aufnehmen kann.

Das stärkste Reduktionsmittel ist in deiner Übersicht Li.
Das stärkste Oxidationsmittel ist in deiner Übersicht Au3+.
LG
ja ich weiß
aber warum?