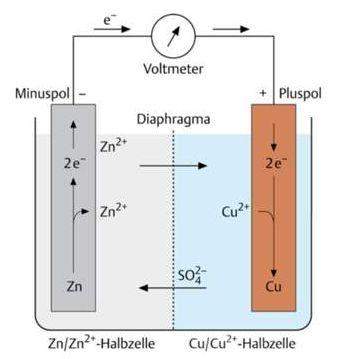
Negativer pH?
Wenn man zur Berechnung des pH die Gleichung pH = -lg c(H₃O⁺) verwendet, dann erhält man dann natürlich als Ergebnis auch einen negativen pH oder einen pH>14.
Diese Gleichung gilt aber nur für verdünnte Lösungen, also c(H₃O⁺) ≤ 1mol/L bzw. c(OH⁻) ≤ 1mol/L.
Begründung:
Für die Autoprotolyse des Wassers H₂O + H₂O ⇌ H₃O⁺ + OH⁻
besteht das Massenwirkungsgesetz:
[c(H₃O⁺) · c(OH⁻)] : c(H₂O)² = K
(K wird durch Leitfähigkeitsmessungen ermittelt).
Die Stoffmenge n(H₂O) von V(H₂O) = 1L bei der Dichte ρ(Wasser) = 1g/cm³ ist
m(H₂O)/M(H₂O) = 1000 g /[18 g/mol] ≈ 55,55 mol/L.
In einer verdünnten Lösung (s.o.) und nur in dieser, ist c(H₂O) = const. Man bezieht nun diese Konstante in die Konstante K des MWG mit ein und erhält als neue Konstante Kw, das Ionenprodukt des Wassers:
c(H₃O⁺) · c(OH⁻) = Kw = 10⁻14 mol²/L²
(Kw ist temperaturabhängig und hier nur gültig für ϑ = 22 °C)
In verdünnten wässerigen Lösungen ist dieses Produkt konstant, wenn die Temperatur ϑ = const.
Es ist weiter in einer neutralen Lösung
c(H₃O⁺) = c(OH⁻) = Wurzel aus [10⁻¹⁴ mol²/L²] = 10⁻⁷mol/L
Für die Oxoniumionenkonzentration verwendet man als Maßzahl den negativen Exponenten der Zehnerpotenz dieser Konzentration und bezeichnet sie als pH.
pH = -lg c(H₃O⁺)
Kurz zusammengefasst: Der pH gilt nur für Lösungen in denen c(H₃O⁺) ≤ 1mol/L bzw. c(OH⁻) ≤ 1mol/L.