Ph-Wert Berechnung Ba(OH)2?
Hallo, ich habe hier die Aufgabe vor mir einen PH-Wert von einer Bariumhydroxid-Lösung zu berechnen.
Nun ist die Stoffmengenkonzentration von 0,040 mol/L gegeben.
Was ich jetzt nicht verstehe: wieso muss ich sie gegebene Stoffmengenkonzentration mal 2 nehmen? Klar hab ich 2xOH^- Ionen in meiner Barium Lösung, aber die sind doch eigentlich in der Stoffmengenkonzentrazion (c=n/V) bereits berücksichtigt? Wieso also nochmal mal 2?
Vielen Dank im Voraus für die Antwort :)
2 Antworten

Das gegebene Bariumhydroxid ist gelöst, wobei es in seine ursprünglichen Ionen - Bariumion und zwei Hydroxidionen - zerfällt. Das Ganze lässt sich hierbei mit der folgenden Reaktionsgleichung beschreiben.
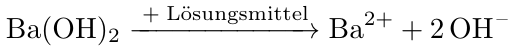
Aus der obigen Reaktionsgleichung geht hervor, dass aus einem Mol Bariumhydroxid, ein Mol Bariumkationen und zwei Mol Hydroxidanionen hervorgehen. Das heißt, dass die Stoffmenge - und somit die Konzentration - der Hydroxidanionen doppelt so groß ist, wie die des Bariumhydroxids. Das Ganze trifft hierbei analog auf die Konzentrationen zu. Das heißt, dass wir auf einen Liter im Endeffekt die doppelte Stoffmenge an Hydroxidionen haben, weswegen die Konzentration der Hydroxidionen auch doppelt so hoch ist, wie die des Bariumhydroxids. Das Ganze lässt sich hierbei folgendermaßen berechnen:
Folglich liegt eine Konzentration von 0.08 mol/l an Hydroxidionen vor. Da sich der pH-Wert aber direkt nur mit Protonen (H+) berechnen lässt, müssen wir anfänglich auf den pOH-Wert zurückgreifen.
Mithilfe des folgenden Zusammenhanges zwischen pH-Wert und pOH-Wert, lässt sich der pH-Wert berechnen.
Sollten wir nun unsere Werte in die Gleichung einsetzen, so erhalten wir den Wert des pH-Wertes.
Somit beträgt der pH-Wert ungefähr 12.903.
~Johannes
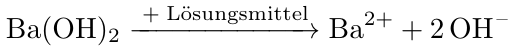


Ba(OH)₂ ⟶ Ba²⁺ + 2 OH⁻
Wenn Du 0.04 mol Ba(OH)₂ im Liter hast, dann liefert das 0.04 mol/l Ba²⁺ und 0.08 mol/l OH⁻, also pH=12.90.

Vielen Dank für die ausführliche Antwort! :)