Oxidationszahl?N2O?
HÄLLO
Warum hat beim N2O das N die Oxidationszahl +I also jetzt zeichnerisch gedacht?
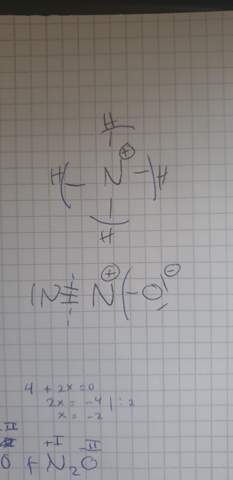
Ich meine bei NH4 werden alle Bindungen dem elketronegativeren Atom (in dem Fall N) zugewiesen. Also braucht das N drei Elektronen weniger (OZ: -III)
Und jetzt bei N2O: O bekommt die Bindung zwischen ihm und dem einen N. Das N in der Mitte teilt die drei Bindungen zwischen ihm und dem anderen N. Also braucht das N in der Mitte noch zwei Elektronen(OZ: +II) und das N links hat dann OZ 0, denn es hat bereits 5 e-
Danköö
1 Antwort

Einfach das Ganze nicht zu sehr überdenken. Oxidationszahlen sind nur eine Krücke und basieren eher auf einem rein formalen Vorgehen.
Hier ist es einfach so, dass Sauerstoff generell (mit wenigen Ausnahmen) die Oxidationszahl -II hat und deshalb für jedes N-Atom nur +I übrigbleibt um ein neutrales Gesamtmolekül darzustellen.
Die tatsächliche Elektronenverteilung ist sowieso nicht wirklich eindeutig und wird näherungsweise nur über mehrere mesomere Grenzstrukturen fassbar.
Was oft hilft ist sich typische Reaktion einer Verbindung vorzunehmen und zu schauen welche Elektronen wohin gewandert sein müssen.
Bei N2O wäre der Zerfall in N2 und O2 typisch:
2 N2O -> 2 N2 + O2 => da die 2 Sauerstoffatome insgesamt 4 e- abgeben, müssen die 4 N-Atome also insgesamt je 1e- aufnehmen. D.h. im N2O hat der Stickstoff dann eben +I als Oxzahl.
Ob in irgendeiner tieferen Realität die Oxidationszahl zwischen den N fluktuiert (+II & 0, +I & +I; 0 & +2) ist egal, weil der tatsächlich abgefragte Wert 2 e- für 2 N beträgt und damit +I ausreichend genau die Realität beschreibt.