Newmann-Projektion von Threonin?
n'Abend,
Die energieärmste Konfiguration (Newmann-Projektion) von Threonin soll gefunden werden
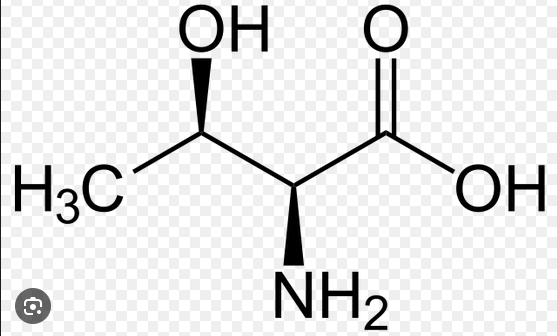
Ich weiß daß man bei der Newmann-Projektion quasi auf ein C schaut und dann alle Bindungen von diesem C wie ein "Y" in die vordere Ebene zeichnet. Die Bindungen vom hinteren C-Atom zeigen dann "von dem Kreis" weg, sozusagen.
jetzt hab ich vier verschiedene Newmann-projektionen im Netz gefunden
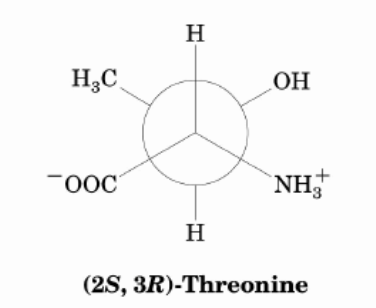
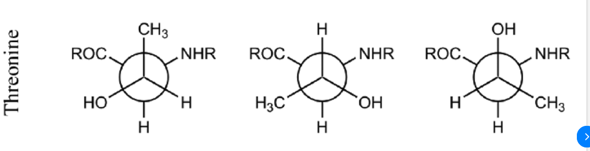
Irritiert mich ei wenig. Welches ist denn jetzt die richtige Version?
Ich weiß daß es auf jeden Fall gestaffelt sein muß um die "energieärmste" Version zu finden, aber nicht welches C-Atom ich vorne und welches hinten malen muss. In unserem Skript ist leider nur ein Beispiel mit 2 C-Atomen, hier haben wir es aber mit 4 verschiendenen zu tun.
Was soll ich tun?
Mit freundlichen Grüßen,
3 Antworten

Moin,
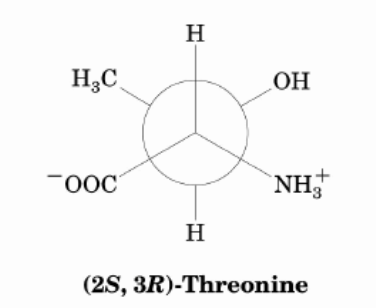
die sind alle möglich. In deiner ersten Darstellung einer Newman-Projektion ist das C2-Atom im Zentrum vorne und das C3 hinten: (2S, 3R)-Threonin
In den Abbildungen darunter betrachtest du die Threonine dagegen von der anderen Seite (C3 ist vorne im Zentrum, C2 dahinter).
Ich persönlich würde die obere Darstellung bevorzugen (weil C2 vor C3 in der Kette kommt).
Außerdem hast du ja schon selbst geschrieben, dass wohl eine gestaffelte Formation die energieärmste sein müsse.
Und hier ist wieder die erste Darstellung auch noch die energieärmste Konformation, weil H und H, NH3+ und CH3 sowie OH und COO– jeweils zueinander in anti-Position stehen. Das ist günstiger als andere gestaffelte gauche-Stellungen.
Daher: am energieärmsten ist
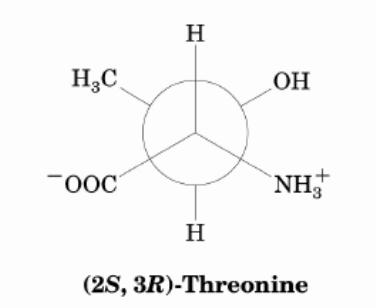
LG von der Waterkant

Moin,
das eine ist eine protonierte Aminogruppe, –N+H3 (also quasi ein –NH2, an das noch ein H+ gebunden ist). Das andere ist eine depronierte Carboxygruppe, –COO– (also im Grunde ein –COOH, von dem ein H+ abgespalten wurde). Die protonierte Aminogruppe bezeichnet man auch als Ammoniumgruppe, die deprotonierte Carboxygruppe als Carboxylatgruppe.
Das macht man häufig so, weil die Aminosäuren sehr selten mit einer Aminogruppe und einer Carboxygruppe vorliegen, sondern als sogenannte Zwitterionen (Zwitterion, weil die Ammoniumgruppe positiv geladen ist, während die im gleichen Molekül vorkommende Carboxylatgruppe negativ geladen ist; positiv UND negativ geladenes Ion = Zwitterion).
Was die Substituenten angeht, stimmt deine Aufzählung nicht ganz: An C2 ist einerseits eine Aminogruppe (oder Ammoniumgruppe) gebunden. Außerdem die Carboxygruppe (oder Carboxylatgruppe) sowie ein Wasserstoff. Die vierte Bindung führt zum C3, das in dieser Darstellung der Newman-Projektion hinten liegt. Die Bindungen an C2 siehst du als durchgezogene Linie zum Zentrum des Kreises. Das Zentrum des Kreises ist dann das C2-Atom.
Am hinter der Papierebene liegende C3-Atom ist dann eine Methylgruppe, eine Hydroxygruppe und wieder ein Wasserstoffatom gebunden. Die vierte Bindung führt zum vorne liegenden C2-Atom. Da die Bindungen von C3 hinter der Papierebene liegen, siehst du deren Bindungen nur bis zum Rand des Kreises.
Ich hoffe, es ist jetzt etwas klarer...
LG von der Waterkant

Vielen Dank, jetzt ergibt alles einen Sinn. Das mit den Zwitterionen wusste ich noch gar nicht :D
Du hast die beiden nach vorne zeigenden Substituenten (OH) und (NH2) auf die rechte Seite gemacht. Konvention oder Willkür? Hab dazu leider keine Regel gefunden :)

Nein, das ist keine Willkür. Natürliche Aminosäuren in Proteinen (= proteinogene Aminosäuren) sind L-alpha-Aminosäuren. Das bedeutet einerseits, dass die Aminogruppe (Ammoniumgruppe) am C2-Kohlenstoff gebunden ist (am sogenannten alpha-C-Atom), aber andererseits auch, dass in einer Fischer-Projektion diese funktionelle Gruppe auf der linken Seite steht (L wie laevus - links). Das ergibt nach der CIP-Nomenklatur (Cahn-Ingold-Prelog) am C2-Atom die absolute Konfiguration 2S (S wie sinister - links). Und da steht die Aminogruppe (Ammoniumgruppe) immer rechts von der Carboxygruppe (Carboxylatgruppe). Besser ausgedrückt: die Reihenfolge der Substituenten N vor C vor H verläuft links herum - darum auch S!
Im L-Threonin ist dann noch die absolute Konfiguration an C3 (CIP-Nomenklatur) 3R, so dass die Hydroxygruppe links von der Methylgruppe liegt. Hier ist die Prioritätenreihenfolge der Substituenten O vor C vor H, was an C3 rechtsherum führt (R wie rectus - rechts).
Wenn du also eine Darstellung in der Newman-Projektion wählst und dabei das Wasserstoffatom nach oben stellst, müssen die Aminogruppe (Ammoniumgruppe) rechts und die Carboxygruppe (Carboxylatgruppe) links liegen.
Da die Hydroxygruppe am hinteren C3-Atom von dir weg (hinter die Papierebene) weist und das Wasserstoffatom dieses C-Atoms in der Darstellung nach unten zeigt, liegt auch hier die Hydroxygruppe auf der rechten Seite des Betrachters.
Keine Willkür, sondern Übereinstimmung mit den Konfigurationsregeln S und R nach dem CIP-Prinzip...
Wenn du das jetzt nicht verstanden hast, mach dir nichts daraus. Die Stereochemie und ihre Nomenklatur ist zwar grundsätzlich leicht zu verstehen, aber am Anfang gewöhnungsbedürftig...
LG von der Waterkant

Danke für die Erklärung. Also ich verstehe dass S linkskonfiguriert ist, weil wenn ma einen Pfeil am C2-Atom machen würde von N nach C nach H würde der nach links laufen und beim C3 -Atom von O nach C nach H würde er nach rechts laufen.
Was ich hingegen noch nciht gnanz verstehe ist, warum jetzt die Aminogruppe rechts und die Carboygruppe links liegt. Weil wenn wir es die S-Konfiguration bestimmen ist dass N ja ganz unten, das C rechts und das H links. Also ist die Carboxlygruppe doch rechts unter dem H-Atom und die Aminogruppe links (zumindest beim Ermitteln der S-Konfiguration). Ich verstehe nicht, wie die Aminogruppe dann nach rechts wandert.
Ist es, weil sie die höhere Priorität hat bei der S-Konfiguration? Kann aber auch nicht sein, weil bei dem 3-C-Atom gilt ja O vor C vor H, es läuft also nach rechts. Und O hat die höhere Priorität als C - und jetzt schreibst du aber, daß die Hydroxygruppe links vom C liegt. Kann man sagen dass bei S die höhere Priorität rechts ist und bei R die höhere Priorität links. Und weil H beim 3. C-Atom nach vorne zeigt, dreht man es dan einfach um (also höhere Priorität von R auch nach rechts, wegen Umkehrung)?

Normalerweise ist es ja so, dass diejenige Konformation (nicht Konfiguration) energetisch bevorzugt ist, bei der die Substituenten mit dem höchsten räumlichen Anspruch einen möglichst hohen Abstand zueinander haben. Aber ich denke, dass neben diesen räumlichen Betrachtungen auch die polaren Wechselwirkungen eine Rolle spielen, wenn die Substituenten keine reinen CH-Spezies sind. Bei den Aminosäuren ist im pH-Bereich um den Isoelektrischen Punkt herum die Säurefunktion deprotoniert (Carboxylat-Ion) und die Aminofunktion protoniert. Insofern ist es naheliegend, anzunehmen, dass sich eine intramolekulare Wasserstoffbrückenbindung zwischen dem H der Alkoholfunktion und dem negativen O der Carboxylatfunktion ausbildet. Dabei entsteht dann ein sechsgliedriger Ring, wobei dabei die Sesselkonformation energetisch die stabilste ist. Ich würde also im ersten Bild der Neumann-Projektion um 120° drehen.
Da ich allerdings lange nicht mehr so am Puls der Zeit bin, kann ich meine Antwort leider nicht mit Quellen belegen. Vielleicht liege ich auch falsch, Korrekturen sind ausdrücklich gerne willkommen!

Das sind Gleichgewichte, die man über NOE-NMR bei verschiedenen Temperauren messen können sollte.
Intramolekulare H-Brücken können wir hier vernachlässigen.
Mir erscheint es logisch, dass sich Carboxylat und Alkohol am stärksten abstoßen. Außerdem sollte es ungünstiger sein, wenn ein Substituent "zwischen zwei anderen" sitzt. Von daher: die obere bzw. mittlere Form.
Danke für die Antwort. Mir ist nur nicht so ganz klar, woher das "-OOC" kommt Du schreibst, daß das 2 C.Atom vorne und das 3. C-Atom hinten ist. Am 2. C-Atom hängt links ein C, rechts ein C, vorne ein NH2 und hinten ein H. Jetzt steht aber vorne in der Newmann-ProjektioN. H, -OOC und NH3. Wieso NH3? Es hängt doch NH2 am 2. C-Atom. ? Wieso -COO. Ich könnte noch verstehen, daß an den C-Aomen links und rechts ein OH bzw. eine Säure dranhängt, dann käme man auf COH oder COOH. Aber wie kommt man auf -OOC. Ich kann das Bildchen von der NEwmann-Projektion nicht mit der Darstellung von Threonin zusammenbringen. Ich hätte jetzt vorne gemalt: NH2 und H. Und am hinteren C-Atom (Das 3. C-Atom) dann OH.